第三章单元测试
以石墨为阳极,电解 0.01 mol·kg-1 NaCl 溶液,在阳极上首先析出( )。
已知:
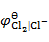 = 1.36 V ,
= 1.36 V ,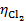 = 0 V,
= 0 V,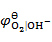 = 0.401V,
= 0.401V,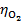 = 0.8 V。
= 0.8 V。塔菲尔经验式
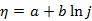 ,用以描述超电势(
,用以描述超电势(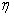 )与电流密度(j)的关系(式中a、b为常数),其适应的范围是( )。
)与电流密度(j)的关系(式中a、b为常数),其适应的范围是( )。当电流通过原电池或电解池时,电极电势将偏离平衡电极电势而发生极化。当电流密度增大时,通常将发生( )。
当发生极化作用时,两电极的电极电势的变化为( )。
用铜电极电解CuCl2的水溶液,不考虑超电势,在阳极上将会发生的反应为(已知
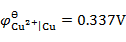 ,
,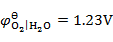 ,
,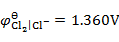 )( )。
)( )。已知
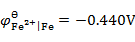 ,
,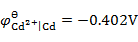 ,将Fe(s)和Cd(s)的粉末投入含Fe2+(0.10 mol×kg -1)和含Cd2+(0.001 mol×kg -1)的溶液中,Fe(s)和Cd(s)粉将( )。
,将Fe(s)和Cd(s)的粉末投入含Fe2+(0.10 mol×kg -1)和含Cd2+(0.001 mol×kg -1)的溶液中,Fe(s)和Cd(s)粉将( )。298K时,在0.10 mol×kg -1的HCl溶液中,氢电极的可逆电势约为-0.06V,当用铜电极电解此溶液,氢在Cu电极上的析出电势应( )。
通电于含有相同浓度的Fe2+,Ca2+,Zn2+和Cu2+的电解质溶液,已知
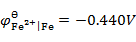 ,
,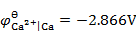
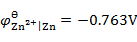 ,
,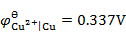 ,设H2因有超电势而不析出,则这些金属在阴极析出的次序为 ( )。
,设H2因有超电势而不析出,则这些金属在阴极析出的次序为 ( )。可充电电池在充电和放电时的电极反应刚好相反,则充电与放电时电极的极性——正极、负极、阴极和阳极——的关系为( )。
298K时,H2(g)在Zn(s)上的超电势为0.70V,已知
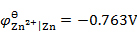 。现在电解一含有Zn2+(
。现在电解一含有Zn2+(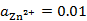 )的溶液,为了使H2(g)不与Zn(s)同时析出,溶液的pH应至少控制在( )。
)的溶液,为了使H2(g)不与Zn(s)同时析出,溶液的pH应至少控制在( )。Tafel公式
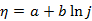 的适用范围是( )。
的适用范围是( )。电解金属盐的水溶液时,在阴极上( )。
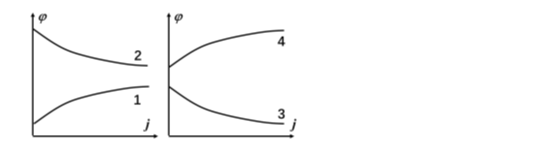
下列示意图描述了原电池和电解池中电极的极化规律,其中表示原电池阳极的是( )。
在电解AgNO3时,电极发生极化时( )。
以下现象与电化学腐蚀无关的是( )。
下列关于化学电源的叙述错误的是( )。
下列对铁表面防护方法中,属于“电化”保护的是( )。
溴-锌蓄电池的基本结构是用碳棒作两极,用ZnBr2溶液作电解液,现有四个电极反应:①Zn – 2e-= Zn2+ ②Zn2+ + 2e- = Zn ③Br2 + 2e- = 2Br- ④2Br-–2e- = Br2,充电时的阳极和放电时的负极反应分别依次为( )。
用铂电解氯化铜溶液时,阳极放出氧气。( )
- 电化学中,用电流密度来表示电极反应速率。( )
用铂电极电解硫酸铜溶液时,溶液pH值升高。( )
极化和超电势是同一个概念。( )
- 电解、电镀、化学电源和电化学腐蚀都是热力学不可逆过程。( )
- 阳离子在阴极上析出时,阴极电势比其可逆电势更负。( )
对原电池,负极极化曲线即阴极极化曲线。( )
分解电压对电解过程是极有意义的数据,当电极、电解液、温度等一定时,分解电压很稳定,测量时重复性好。( )
超电势大小是衡量极化程度的量度。( )
A:
无气体析出
B:O2(g)
C:Cl2与O2混合气体
D:Cl2(g)答案:Cl2(g)
A:
任何电流密度下的气体电极过程
B:任何电流密度下的浓差极化 C:大电流密度下的浓差极化 D:大电流密度下的电化学极化A:电解池的阳极电势减小 B:无法判断 C:原电池的正极电势增高 D:原电池的负极电势增高
A:
j阳变大,j阴变小
B:j阳变小,j阴变大
C:两者都变小 D:两者都变大
A:析出氧气 B:析出铜 C:铜电极氧化 D:析出氢气
A:
Fe(s)溶解,Cd(s)不溶
B:都不溶解
C:Fe(s)不溶,Cd(s)溶解
D:都溶解
A:小于-0.06V B:无法判定 C:等于-0.06V D:大于-0.06V
A:Ca → Cu → Zn → Fe B:Cu → Fe → Zn → Ca C:Ca → Fe→ Zn → Cu D:Ca → Zn → Fe → Cu
A:正极、负极相同,阴极和阳极刚好相反 B:正极、负极相同,阴极和阳极也相同 C:正极、负极改变,阴极和阳极刚好相反 D:正极、负极改变,阴极和阳极相同
A:pH>2.72 B:pH>2.06 C:pH>7.10 D:pH>8.02
A:
可以是阴极超电势,也可以是阳极超电势
B:仅限于j»0,电极电势稍有偏差的情况
C:仅限于阴极超电势,可以是析出氢,也可以是其他
D:仅限于氢超电势
A:还原电势愈负的粒子愈容易析出 B:还原电势与其超电势之代数和愈正的粒子愈容易析出 C:还原电势愈正的粒子愈容易析出 D:还原电势与其超电势之和愈负的粒子愈容易析出
A:曲线4 B:曲线3 C:曲线2 D:曲线1
A:两极之间电势差增大 B:
阴极附近 Ag+ 浓度增加
C:阴极的还原电极电势增大 D:电解池电阻减小A:黄铜(铜锌合金)制作的铜锣不易产生铜绿 B:银制奖牌久置后表面变暗 C:铁制器件附有铜制配件,在接触处易生铁锈 D:生铁比软铁芯(几乎是纯铁)容易生锈
A:普通锌锰干电池中碳棒为正极 B:氢氧燃料电池的正极是通入氧气的那一极 C:
铅蓄电池中覆盖着PbO2的电极板是负极板
D:碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高A:电镀 B:Fe件上嵌Zn块 C:表面喷漆 D:加缓蚀剂
A:③① B:
④①
C:②③
D:②④A:错 B:对
A:错 B:对
A:错 B:对
A:错 B:对
A:错 B:对
A:对 B:错
A:错 B:对
A:对 B:错
A:错 B:对

