第七章测试1. 电解金属盐的水溶液时,在阴极上,( )的反应优先进行。
A:标准电极电势最低; B:标准电极电势最高; C:极化电极电势最低。 D:极化电极电势最高;
答案:D
2.电解KOH水溶液,当析出1 mol氢气和0.5 mol氧气时,通过的电荷量是( ) C·mol-1。
A:2 B:1.5 C:无法确定 D:1 3.对于电解池与原电池极化的差别描述,下列不正确的是 ( )
A:电解池极化,阴极电势变小,阳极电势变大,消耗电能增大; B:电解池极化,阴极电势变大,阳极电势变小,消耗电能增大。 C:原电池极化,阴极电势变小,阳极电势变大,电池做功增大; D:原电池极化,阴极电势变大,阳极电势变小,电池做功减小; 4.电池的可逆包括三方面的含义, 不正确的是 ( )。
A:物质可逆性 B:电极可逆性。 C:能量可逆性 D:实际可逆性 5.离子独立运动定律适用于( )。
A:弱电解质溶液 B:无限稀电解质溶液 C:理想稀溶液 D:强电解质溶液 6.双液电池包含两种不同电解质或不同浓度的同一电解质。电解质在接触面产生一定的液接电势差。关于液接电势下列说法正确的是( )。
A:可用对消法测量其大小 B:可以用盐桥完全消除 C:可通过电极电势的能斯特公式和离子迁移数进行准确计算 D:难于实验测定也难于计算 7.在温度一定时,影响电解质水溶液的离子平均活度系数的因素是( )。
A:离子的本性 B:共存的它种离子的性质 C:离子浓度及离子电荷数 D:电解质的强弱 8.电流通过电极时,电极电势偏离平衡电极电势的现象称为极化,是不可逆的。( )
A:对 B:错 9.双液电池中不同电解质溶液间或不同浓度的同一种电解质溶液的接界处存在液接电势,可采用加盐桥的方法减少或消除。( )
A:错 B:对 10.恒温下,电池可逆放电时,电池的能量转化效率超过100% 需要满足( )。
A:Qr,m>0 B:Qr,m<0 C:Qr,m<0 D:不可能超过100%。 1. 下列对原电池的描述哪个是不准确的:( )
A:在电池外线路上电子从阴极流向阳极 B:在阳极上发生氧化反应 C:当电动势为正值时电池反应是自发的 D:电池内部由离子输送电荷 2.金属与溶液间电势差的大小和符号主要取决于:( )
A:溶液中金属离子的浓度 B:金属的表面性质 C:金属与溶液的接触面积 D:金属的本性和溶液中原有的金属离子浓度 3.电池(1) Ag(s)│AgNO3(a1)‖AgNO3(a2)│Ag(s) 电动势为 E1 电池(2) Ag(s)│AgNO3(a1)┆AgNO3(a2)│Ag(s) 电动势为 E2,其液接电势为 Ej。三个电动势间的关系为: ( )
A:E1 = E2 B:E1=E2+Ej C:E1=E2-Ej D:无法确定 4.
有两个电池,电动势分别为E1和E2:
H2(pƟ)│KOH(0.1 mol/kg)│O2(pƟ) E1
H2(pƟ)│H2SO4(0.0l mol/kg)│O2(pƟ) E2
比较其电动势大小: ( )
A:E1> E2 B:E1= E2 C:E1< E2 D:不能确定 5.用对消法测定由电极 Ag(s)│AgNO3(aq) 与电极 Ag,AgCl(s)│KCl(aq) 组成的电池的电动势,下列哪一项是不能采用的? ( )
A:标准电池 B:直流检流计 C:饱和KCl盐桥 D:电位计 6.可逆电池反应的ΔH与反应热Q不相等。( )
A:对 B:错 7.盐桥能完全消除液界接触电势。( )
A:错 B:对 8.标准电极就是标准氢电极。( )
A:错 B:对 9.若计算得可逆电池的电动势为负值, 表明该电池是非自发电池,表示此电池反应的方向不能正向进行,但可以逆向进行。( )
A:错 B:对 10.用对消法(补偿法)测定可逆电池的电动势,主要是为了消除电极上的副反应。( )
A:错 B:对 1. 关于界面张力的说法不正确的是( )。
A:界面张力等于增加单位界面面积时系统必须得到的可逆界面功 B:界面张力是恒温恒容下,单位表面积中的分子所具有的吉布斯函数值 C:界面中单位长度的收缩张力 2. 相同温度下,纯水、盐水、皂液相比,其表面张力的排列顺序是( )。
A:盐水 > 纯水 > 皂液 B:皂液 > 纯水 > 盐水 C:纯水 > 盐水 > 皂液 3.下列说法中,不正确的是( )。
A:采用吉布斯界面相模型时,界面层中物质i的量不会等于零 B:实际界面层中物质i的量永远为正值 C:采用吉布斯界面相模型时,界面层中物质i的量可以为负值 4. 空气中直径为D的气泡,则泡内外压差可采用( )计算。
A:
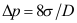 B:
B: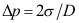 C:
C: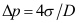 5. 水在玻璃毛细管内上升的高度与( )成反比。
5. 水在玻璃毛细管内上升的高度与( )成反比。A:液体的表面张力 B:毛细管半径 C:饱和蒸气压 6. 25℃时半径为1×10-8m水滴的饱和蒸汽压是平面液体饱和蒸汽压的1.111倍,即
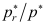 =1.111。当水滴半径为1×10-9m时,
=1.111。当水滴半径为1×10-9m时,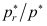 =( )。
=( )。A:3.217 B:2.865 C:1.111 7. 在浓度较大时,溶液的气液界(表)面张力与浓度的关系为
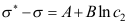 ,这里A、B为常数,则单位界面吸附量
,这里A、B为常数,则单位界面吸附量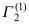 =( )。
=( )。A:
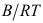 B:
B: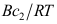 C:
C: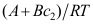 8. 对于气液界面,杨氏方程的正确形式是( )。
8. 对于气液界面,杨氏方程的正确形式是( )。A:
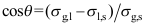 B:
B: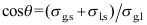 C:
C: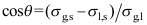 9.气体在固体表面发生物理吸附,则气体的G、H、S的变化满足( )。
9.气体在固体表面发生物理吸附,则气体的G、H、S的变化满足( )。A:
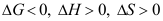 B:
B: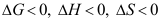 C:
C: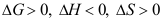 10. 溶质在界面的单位界面吸附量与浓度c的关系为
10. 溶质在界面的单位界面吸附量与浓度c的关系为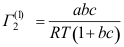 ,这里a、b均为常数,则溶质在界面上的饱和吸附量
,这里a、b均为常数,则溶质在界面上的饱和吸附量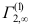 是( )。
是( )。A:
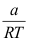 B:
B: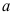 C:
C: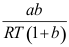 1.在300 K时,如果分子A和分子B要经过107次碰撞才能发生1次反应,这个反应的临界能是:( )
1.在300 K时,如果分子A和分子B要经过107次碰撞才能发生1次反应,这个反应的临界能是:( )A:10.5 kJ.mol-1 B:40.2 kJ.mol-1 C:-15.7 kJ.mol-1 D:170 kJ.mol-1 2.在碰撞理论中,概率因子小于1的主要原因是( )。
A:分子碰撞不够激烈 B:反应系统是非理想的 C:分子间有作用力 D:空间位阻效应 3.于简单碰撞理论下列描述正确的是 ( )。
①碰撞参数越大,反应越激烈
②互撞分子在连心线方向上的相对平动能超过临界能的碰撞才是能导致反应的碰撞。
③碰撞理论说明了阿仑尼乌斯经验式中的指前因子相当于碰撞频率,故又称为频率因子
④互撞分子的相对总动能超过E才是有效碰撞。
A:②③ B:①② C:③④ D:①④ 4.按照Linderman理论,当反应物的压力或浓度由高变低时,单分子反应常表现出( )。
A:反应速率常数由大到小变化 B:反应级数由二级变成一级 C:反应级数由一级变为二级,由小变大 D:反应速率常数不变 5.阿仑尼乌斯活化能Ea,阈能Ec和活化焓
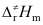 三者数值大小关系,下列不等式正确的是( )。
三者数值大小关系,下列不等式正确的是( )。A:Ec>Ea>
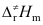 B:
B: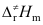 >Ea>Ec
C:Ec>
>Ea>Ec
C:Ec>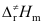 >Ea
D:Ea>Ec>
>Ea
D:Ea>Ec>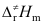 6.按照化学反应速率的过渡态理论,对于气相反应,下列说法不正确的是 ( )
6.按照化学反应速率的过渡态理论,对于气相反应,下列说法不正确的是 ( )。
A:反应过程中,反应分子先形成过渡态 B:活化络合物与反应物之间很快达到平衡 C:反应速率决定于活化络合物的分解速率 D:该理论不考虑分子的内部结构和运动状态 7.在简单碰撞理论中,有效碰撞的定义是( )。
A:互撞分子的总动能超过Ec B:互撞分子的相对总动能超过Ec C:互撞分子的相对平动能在联心线上的分量超过Ec D:互撞分子的内部动能超过Ec 8.设某基元反应在500K时,实验活化能为83.14 kJ/mol,则此反应的临界能为( )。
A:162.01 kJ/mol B:81.06 kJ/mol C:4.291 kJ/mol D:2.145 kJ/mol 9.设对峙反应正方向是放热的,并假定正、逆都是基元反应,则升高温度更利于增大正反应的速率系数。( )
A:错 B:对 10.对于一个在定温、定压下,不做非膨胀功的化学反应来说,△G越负,反应速度越快。( )
A:错 B:对 1.LiCl 的无限稀释摩尔电导率为 115.03×10-4 S·m2·mol-1,在 298 K 时,测得 LiCl 稀溶液中 Li+ 的迁移数为 0.3364,则 Cl- 离子的摩尔电导率 m(Cl-)为: ( )
A:38.70×10-4 S·m2·mol-1 B:76.33×102 S·m2·mol-1 C:76.33×10-4 S·m2·mol-1 D:113.03×10-4 S·m2·mol-1 2.CaCl2 摩尔电导率与其离子的摩尔电导率的关系是: ( )
A:(CaCl2) = m(Ca2+) + m(Cl-) B:(CaCl2) = m(Ca2+) + 2m(Cl-) C:(CaCl2) = ½ m(Ca2+) + m(Cl-) D:(CaCl2) = 2 [m(Ca2+) + m(Cl-)] 3.欲要比较各种电解质的导电能力的大小,更为合理应为 ( )
A:电解质的摩尔电导率值 B:电解质的极限摩尔电导率值 C:电解质的电导率值 D:电解质的电导值 4.浓度为 1.0 mol·dm-3 的强电解质溶液,它的摩尔电导率数值近似于: ( )
A:与电导率相等 B:是电导率的 10-3倍 C:是电导率的 103倍 D:是电导率的 102倍 5.电解硫酸铜溶液时,析出128 g128 g铜(Mr =64),需要通入多少电量? ( )
A:96 500 C500 C B:24 125 C C:48 250 C250 C D:386 000 C000 C 6.在NiI2的水溶液中,通过24 125 C125 C的电量后,沉积出金属镍(Mr=58.7)的质量最接近于: ( )
A:7.3 g B:14.6 g14.6 g C:58.7 g D:29.2 g29.2 g 7.水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对? ( )
A:发生质子传导 B:发生电子传导 C:离子荷质比大 D:离子水化半径小 8.当一定的直流电通过一含有金属离子的电解质溶液时,在阴极上析出金属的量正比于:( )
A:通过的电量 B:阴极的表面积 C:电解质溶液的浓度 D:电解质溶液的温度 9.在饱和 AgCl 溶液中加入 NaNO3,AgCl 的饱和浓度如何变化 ? ( )
A:变小 B:变大 C:不变 D:无法判定 10.已知298 K时, 1.499×10-2 , 2.487×10-2 , 1.265×10-2 ,则 为: ( )
A:2.721×10-2 B:5.251×10-2 C:0.277×10-2 D:2.253×10-2 11.在HAc解离常数测定的实验中,总是应用惠斯顿电桥。作为电桥平衡点的指零仪器,结合本实验,不能选用的是: ( )
A:耳机 B:阴极射线示波器 C:直流桥流计 D:电导率仪 12.在298 K无限稀释的水溶液中,下列离子摩尔电导率最大的是: ( )
A:Mg2+ B:H+ C:La3+ D:NH4+ 13.按 国标(GB),如下单位不正确的是: ( )
A:摩尔电导率: S·m-1·mol-1 B:离子摩尔电导率: S·m2·mol-1 C:电导率: S·m-1 D:电导: S 14.电解质溶液的电导率k≡j/E =∑B│zB│F rB cB/E,式中zB.cB代表B种离子的电荷数及浓度。影响k值的下述分析哪个对? ( )
A:rB.E 及 j 的大小对 k值无影响 B:电流密度 j 愈大,则 k愈大 C:迁移速率 rB愈大,则 k愈大 D:电场强度 E 愈大,则 k愈小 15.电解熔融NaCl时,用10 A10 A的电流通电5 min,能产生多少金属钠? ( )
A:2.545 g2.545 g B:23 g23 g C:2.08 g D:0.715 g0.715 g 16.下列电解质溶液中,离子平均活度系数最大的是 : ( )
A:0.01 mol·kg-1 CuSO4 B:0.01 mol·kg-1 CaCl2 C:0.01 mol·kg-1 NaCl D:0.01 mol·kg-1 LaCl3 17.某一强电解质M v+ X v-,则其平均活度 a 与活度aB之间的关系是: ( )
A:a = aB B:a = aB C:a = (aB)2 D:a = (aB)1/ 18.电导测定应用广泛,但下列问题中哪个是不能用电导测定来解决的?( )
A:求平均活度系数 B:求弱电解质的解离度 C:求难溶盐的溶解度 D:测电解质溶液的浓度 19.18℃时,纯水的 4.89×10-2 ,此时水中m(H+)= m(OH-)=7.8×10-8 mol·kg-1,则18℃时纯水的电导率为: ( )
A:3.81×10-7 S·m-1 B:3.81×10-8 S·m-1 C:3.81×10-6 S·m-1 D:3.81×10-5 S·m-1 20.Ostwald稀释定律表示为: ,它适用于: ( )
A:无限稀释的电解质溶液 B:强电解质溶液 C:解离度很小的弱电解质 D:非电解质溶液 21.在无限稀释的电解质溶液中,正离子淌度 ,正离子的摩尔电导率 和法拉第常数F之间的关系是: ( )
A:z+ F = 1 B:z+ / =F C:z+ =F D: / z+ =F 22.在298 K时,0.002 mol·kg-1 的 CaCl2溶液的平均活度系数±,1与0.002 mol·kg-1 的CaSO4溶液的平均活度系数±,2 相比较是: ( )
A: ±,1 < ±,2 B:±,1 > ±,2 C:±,1 = ±,2 D:无法比较 23.298 K 时, 在下列电池 Pt│H2(p)│H+(a=1)‖CuSO4(0.01 mol·kg-1)│Cu(s)右边溶液中加入 0.01 mol的KOH溶液时, 则电池的电动势将: ( )
A:升高 B:不变 C:降低 D:无法判断 24.下列两电池在 T 相同时,哪个说法正确? (1) H2(g,p1)│H3PO4(a1)│O2(g,p2) E1; (2) H2(g,p1)│KOH(a2)│O2(g,p2) E2 ( )
A:虽对应电极的 E值不等,但E1= E2 B:因电解液不同,故 E1≠ E2 C:因 H2.O2的压力相等,故对应电极的 值相等 D:因对应电极反应相同,故两电池的反应亦相同 25.下列物质的水溶液,在一定浓度下其正离子的迁移数 (tB) 如 A.B.C.D 所列。比较之下选用哪种制作盐桥,可使水系双液电池的液体接界电势减至最小? ( )
A:KNO3 (t(K+ )= 0.5103) B:BaCl2 (t(Ba2+) = 0.4253) C:NaCl (t(Na+) = 0.3854) 26.将一铂丝两端分别浸入含0.1 mol·dm-3 Sn2+和0.01 mol·dm-3 Sn4+的溶液中,这时的电位差为:( )
A:E(Sn4+|Sn2+) - 0.059 B:E(Sn4+|Sn2+)+0.059 C:E(Sn4+|Sn2+)+0.059/2 D:E(Sn4+|Sn2+) - 0.059/2 27.测定溶液的 pH 值的最常用的指示电极为玻璃电极, 它是: ( )
A:氢离子选择性电极 B:第一类电极 C:第二类电极 D:氧化还原电极 28.298 K时, 电池 Pt,H2(0.1p)│HCl(a=1)│H2(p), Pt 的总电动势约为: ( )
A:- 0.059 V B:0.0295 V C:2×0.059 V D:- 0.0295 V 29.电池(1) Ag(s)│AgNO3(a1)‖AgNO3(a2)│Ag(s) 电动势为 E1; 电池(2) Ag(s)│AgNO3(a1)┆AgNO3(a2)│Ag(s) 电动势为 E2,其液接电势为 EJ。三个电动势间的关系为 ( )
A:E1=E2+ EJ B:无法确定 C:E1=E2 D:E1=E2- EJ 30.下列电池不属于浓差电池的是: ( )
A:Na(Hg)A.| NaCl(m1)|AgCl(s)|Ag(s)—Ag(s)|AgCl(s)| NaCl(m2)|Na(Hg)A. B:Tl(Hg)(a1)|Tl+(aq)|Tl(Hg)(a2) C:Ag(s)|AgCl(s)|NaCl(aq)|Na(Hg)A.|NaCl(CH3CN溶液)|Na(s) D:Na(Hg)A.|NaCl(m1)|| NaCl(m2)|Na(Hg)A. 31.一个电池E值的正或负可以用来说明: ( )
A:电池是否可逆 B:电池反应是否达到平衡 C:电池反应自发进行的方向 D:电池反应自发进行的方向和限度 32.下列电池中哪个的电动势与 Cl- 离子的活度无关? ( )
A:Zn│ZnCl2(aq)│Cl2(g)│Pt B:Pt│H2(g)│HCl(aq)│Cl2(g)│Pt C:Hg│Hg2Cl2(s)│KCl(aq)‖AgNO3(aq)│Ag D:Ag│AgCl(s)│KCl(aq)│Cl2(g)│Pt 1.法拉第于1834年根据大量实验事实总结出了著名的法拉第电解定律。它说明的问题是( )
A:通过电解池的电量与发生电极反应的物质的量之间的关系 B:通过电解池的电流与超电势之间的关系 C:电解时电极上析出物质的量与电极面积的关系 D:通过电解池的电流与电势之间的关系 2.若向摩尔电导率为1.4×10-2S·m2·mol-1的CuSO4溶液中,加入1m3的纯水,这时溶液中CuSO4摩尔电导率为:( )
A:降低 B:增高 C:不能确定 D:不变 3.柯尔劳施离子独立运动定律适合于:( )
A:任意浓度的强电解质溶液 B:任意浓度的弱电解质溶液 C:无限稀薄的强或弱电解质溶液 4.实际的电池工作时( )
A:能量转换肯定不可逆,物质变化可能可逆 B:只有能量转换是可逆的 C:只有物质变化是可逆的 D:物质变化和能量转换都是可逆的 5.下例电极中属第二类的是( )
A:K(Ag)|KCl(m) B:Pt|Br2(l)|Br-(a) C:Ag|AgCl(s)|KCl(m) D:Pt|Fe3+, Fe2+ 6.下面的说法中正确的是( )
A:原电池的负极是阴极 B:电解池的正极是阴极 C:原电池的阴极是正极 D:电解池的负极是阳极 7.下列对原电池的描述哪个是不准确的: ( )
A:当电动势为正值时电池反应是自发的 B:在阳极上发生氧化反应 C:在电池外线路上电子从阴极流向阳极 D:电池内部由离子输送电荷 8.电池电动势不能直接用伏特计测量,必须用对消法,这是因为( )
A:伏特计不能保证电池满足可逆工作条件,且其本身有内阻 B:伏特计使用不当 C:伏特计不准确 D:伏特计本身电阻太大 9.氢电极的电极电位值为0。( )
A:错 B:对 10.无论是在酸性介质还是在碱性介质中,氢电极的电极反应是一样的。( )
A:错 B:对 1.物质A发生两个平行的一级反应,若>,两反应的指前因子相近且与温度无关,则升温时下列叙述中正确的是:( )。
A:对反应(1)有利
B:不能确定
C:对反应(2)有利
D:对反应(1)和(2)影响程度等同
2.某化学反应速率常数的单位是mol·m·s,则该化学反应的级数为( )
A:零级
B:二级
C:无法判断
D:一级
3.一定温度下,体系存在一反应,且任何时刻其速率常数之比等于各产物浓度之比,则此反应为:( )。
A:对峙反应
B:连串反应
C:链反应
D:平行反应
4.5/9所需的时间是它反应掉1/3所需时间的2倍,这个反应是( )。
A:一级
B:二级
C:零级
D:三级
5.对于一个化学反应来说,在下列说法中的哪一种是正确的( )。
A:ΔS越负,反应速率越快
B:活化能越小,反应速度越快
C:ΔH越负,反应速率越快
D:活化能越大,反应速度越快
1.下面几种溶胶中,哪个不属于液溶胶 ( )
A:微小泡沫
B:油漆
C:雾
D:牛奶
2.溶胶有三个基本特征,下面哪一个不是 ( )
A:聚集不稳定性
B:高度分散性
C:动力稳定性
D:多相性
3.
溶胶粒子的带电原因包括胶核的表面吸附、表面分子的电离和两相摩擦生电。( )
A:错 B:对 4.
溶胶中胶体粒子的粒径在1~100 nm范围内,溶胶一般都具有明显的丁达尔效应,产生这种现象的原因是胶体粒子对光产生了散射作用。( )
A:对 B:错 5.聚沉值越大的电解质,对溶胶的聚沉能力就越大 ( )
A:错 B:对
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!







