第四章测试1.下列各式哪个表示了化学势?( )
A:
答案:A
2.在273K和标准压力下,水的化学势
A:
A:沸点降低 B:总是放出热量 C:熔点升高 D:蒸气压降低 4.二组分理想液态混合物的总蒸气压( )
A:小于任一组份的蒸气压 B:介于二纯组份的蒸气压之间 C:与混合物的组成无关 D:大于任一组份的蒸气压 5.苯和甲苯能形成理想液态混合物。在20℃时,液体苯的饱和蒸气压p1为9960 Pa,液体甲苯的饱和蒸气压p2为2973 Pa。当20℃时,与等摩尔的苯和甲苯的混合物呈平衡的蒸气中苯的物质的量分数y1是( )
A:1 B:0.23 C:0.77 D:0.3 6.2molA物质和3molB物质在等温等压下混合形成液态混合物。该系统中A和B的偏摩尔体积分别为17.9cm3.mol-1和21.5 cm3.mol-1,则混合物的总体积为( )
A:96.7cm3 B:89.5 cm3 C:98.5 cm3 D:100.3 cm3 7.涉及纯物质标准状态的下列说法中不正确的是( )
A:纯理想气体的标准状态就是标准压力P(100KPa)下的状态 B:纯固体物质的标准状态就是标准压力P(100KPa)下的纯固体 C:不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同 D:纯液体物质的标准状态就是标准压力P(100KPa)下的纯液体 8.理想液态混合物各组分分子间没有作用力。( )
A:对 B:错 9.由纯组分混合成理想液态混合物时没有热效应,故混合熵等于零。( )
A:对 B:错 1.开始用任意量的HCl(g)和NH(g)组成的系统中,反应HCl(g) + NH(g)= NHCl(s)达到平衡时的自由度数 为( )。
A:2
B:1
C:3
D:4
2.在描述恒沸混合物时,下列各点中哪一点是不正确的( )。
A:与化合物一样具有确定的组成
B:其沸点随外压的改变而改变
C:平衡的气相和液相组成相同
D:不具有确定的组成
3.杠杆规则适合于相图中任意两相共存区。( )
A:错 B:对 4.在一个给定的体系中,物种数可因分析问题的角度不同而不同,但独立组分数是一个确定的值。( )
A:错 B:对 5.相图中的点都是代表体系状态的点。( )
A:对 B:错 1.等温等压下, 在A和B组成的均相体系中,若A的偏摩尔体积随A浓度的减小而减小,则B的偏摩尔体积随A浓度的减小而( )。
A:减小
C. 不变
B:不一定
C:增加
2.B物质在相中的浓度大于在相中的浓度,当两相接触时:( )
A:无法确定
B:B由相向相扩散;
C:B由相向相扩散;
D:B在两相中处于扩散平衡;
3.一气体的化学势
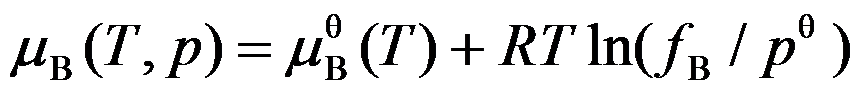 其标准态为( )。
其标准态为( )。A:298.15K, 标准压力下该气体的状态;
B:温度为T、压力p→0 时该气体的状态;
C:fB = 1的状态;
D:温度为T、标准压力下该气体视为理想气体的状态;
4.当温度一定是,纯溶剂的饱和蒸汽压越大,溶剂的液相组成也越大。( )
A:错 B:对 5.在298K时,0.01molkg-1的蔗糖水溶液的渗透压与0.01molkg-1的食盐的渗透压相等。( )
A:错 B:对 1.NH4HS(s)与任意量的NH3(g)及H2S(g)达平衡时,有 ( )
A:C= 1,P = 2,f= 1 B:C= 2,P = 2,f= 2 C:C= 3,P = 2,f= 3 D:C= 2,P = 3,f= 2 2.某一物质X,在三相点时的温度是20℃,压力是200 kPa。下列哪一种说法是不正确的 ( )
A:在25℃和100 kPa下,液体X 是稳定的 B:在20℃以下,X 能以固体存在 C:在20℃时,液体X 和固体X 具有相同的蒸气压 D:在20℃以上,X能以液体存在 3.N2(g)的临界温度是124 K,如果想要液化,就必须 ( )
A:在恒压下降低温度 B:在恒温下增加压力 C:在恒温下降低压力 D:在恒压下升高温度 4.单组份体系的相图中两相平衡线都可以用Clapeyron方程定量描述。( )
A:错 B:对 5.自由度就是可以独立变化的变量。 ( )
A:对 B:错 1.物质A和B形成理想混合物,在温度T时A和B的饱和蒸气压分别为
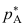 和
和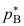 ,并且
,并且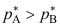 ,气相的平衡蒸气总压为p,下列关系式正确的是( )。
,气相的平衡蒸气总压为p,下列关系式正确的是( )。A:
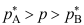 B:
B: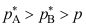 。
C:
。
C: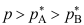 2.在一定温度和压力下,等物质量的物质A和B的理想混合物,当达到气液平衡时,气相组成
2.在一定温度和压力下,等物质量的物质A和B的理想混合物,当达到气液平衡时,气相组成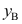 =0.65,液相组成
=0.65,液相组成A:<、< B:>、> C:=、= 3.将4mol甲苯(A)与1mol苯( )的气体放在密闭气缸中恒压冷却,开始凝结第一滴液体时,气相组成yB( )0.2。
A:小于 B:等于 C:大于 4.如二元混合物气液平衡相图中出现正偏差时,下列正确的说法是( )。
A:正偏差强烈时,可形成最高恒沸混合物 B:正偏差强烈时,可形成最低恒沸混合物 C:
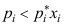 5.下面对于恒沸混合物的描述,何者是不正确的?( ) 。
5.下面对于恒沸混合物的描述,何者是不正确的?( ) 。A:沸点随压力而变化 B:是有确定组成的混合物 C:平衡气相和液相的组成相同 D:组成随压力而变化 6.二元混合物气液平衡相图中出现负偏差的原因,不正确的说法是( )。
A:不同组分间生成氢键而相互缔合 B:溶液中不同组分分子间相互作用较强 C:溶液中不同组分分子间的相互吸引比纯物质弱。 7.要使具有上部会溶点的两组分液液平衡系统成为单相,可采取的措施是( )。
A:升高温度 B:升高压力 C:降低温度 8.对于两个液相
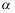 相、
相、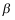 相部分互溶的气液液平衡系统,
相部分互溶的气液液平衡系统, 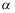 相和
相和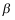 相成平衡的A的分压,则气相中A的分压
相成平衡的A的分压,则气相中A的分压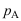 ( )。
( )。A:
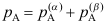 B:
B: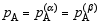 C:
C: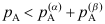 9.对于A、B二元液相部分互溶、具有最低恒沸点的系统,通过精馏方法塔顶得到( )。
9.对于A、B二元液相部分互溶、具有最低恒沸点的系统,通过精馏方法塔顶得到( )。A:最低恒沸物 B:纯A C:纯B 10.在0.1Mpa下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点( )。
A:必高于373.15K B:必低于373.15K C:取决于水与有机物的相对数量 D:取决于有机物的分子量大小 1.
在相图中,当系统处于下列哪一点时,只存在一个相 ( )
A:临界点 B:恒沸点 C:低共熔点 D:熔点 2.
A和B两液体混合物在T-x图上出现最低点,则该混合物对拉乌尔定律产生 ( )
A:较小的负偏差 B:较大的负偏差 C:较小的正偏差 D:较大的正偏差 3.
对三组分体系而言,体系最多可以有几个自由度? ( )
A:3 B:4 C:2 D:5 4.
对恒沸混合物的描述,下列各种叙述中哪一种是不正确的? ( )
A:其沸点随外压的改变而改变 B:不具有确定的组成 C:与化合物一样,具有确定的组成 D:平衡时,气相和液相的组成相同 5.
某一固体,在25℃和大气压力下升华,这意味着:( )
A:三相点的压力大于大气压力 B:固体比液体密度小些 C:三相点的压力小于大气压力 D:固体比液体密度大些 6.
如右图所示,当物系点在通过A点的一条直线上变动时,则此物系的特点是: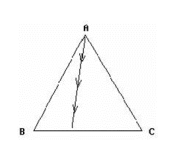 ( )
( )
A:C的百分含量不变 B:B的百分含量不变 C:A的百分含量不变 D:B和C的百分含量之比不变 7.
FeCl3与水可生成FeCl3·2H2O, FeCl3·5H2O, FeCl3·6H2O,和FeCl3·7H2O,四种固体水合物,则在一定温度下与水蒸气平衡的含水盐最多为 ( )
A:3种 B:2种 C:不可能有共存的含水盐 D:1种 8.
将固体 NH4HCO3(s) 放入真空容器中,恒温到 400 K,NH4HCO3 按下式分解并达到平衡: NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g),则下列正确的为: ( )
A: C= 1,F = 2,f = 0 B:C= 2,F = 2,f = 1 C:C= 2,F = 1,f = 2 D:C=1,F = 2,f = 1 9.
298 K 时,蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度数为: ( )
A:C= 2,F = 2,f = 2 B:C= 2,F = 1,f = 3 C:C= 2,F = 2,f = 1 D:C= 2,F = 1,f = 2 10.
液态氨的饱和蒸气压与温度的关系为 ln(p/pa) = 24.38 – 3063/(T/K) ,氨的熔化热 ΔfusHm= 5.7 kJ· mol-1,则氨的摩尔升华热ΔsubHm为( )
A:
19.8 kJ· mol-1
B:-19.8 kJ· mol-1
C:31.2 kJ· mol-1
D:-31.2 kJ· mol-1
1.在一定温度和压力下,对于一个化学反应,能用以判断其反应方向的是 ( )A:ΔrGm B:ΔrG C:ΔrHm D:Kp 2.25℃时水的饱和蒸气压为3.168 kPa,此时液态水的标准生成吉布斯自由能ΔfG 为- 237.19 kJ·mol-1,则水蒸气的标准生成吉布斯自由能为: ( )
A:-245.76 kJmol-1 B:-245.04 kJmol-1 C:-229.34 kJmol-1 D:-228.60 kJmol-1 3.理想气体反应 的 与温度 的关系为: (T/K),若使在标准状态下的反应向右进行,则应控制反应的温度: ( )
A:必须低于409.3 K B:必须高于409.3 K C:必须等于409.3 K D:必须低于409.3 °C 4.在1100℃时,发生下列反应: (1) C(s) + 2S(s) = CS2(g) K1= 0.258; (2) Cu2S(s) + H2(g) = 2Cu(s) + H2S(g) K2= 3.9×10-3; (3) 2H2S(g) = 2H2(g) + 2S(s) K3= 2.29×10-2 ; 则1100℃时反应 C(s) + 2Cu2S(s) = 4Cu(s) + CS2(g) 的 K为: ( )
A:8.99×10-5 B:3.69×10-8 C:8.99×10-8 D:3.69×10-5 5.反应 CH3COOH(l) + C2H5OH(l) = CH3COOC2H5(l) + H2O(l) 在25℃时平衡常数K为4.0,今以 CH3COOH 及 C2H5OH 各1mol混合进行反应,则达平衡最大产率为: ( )
A:0.334% B:50.0% C:33.4% D:66.7% 6.过饱和溶液中溶剂的化学势 与纯溶剂的化学势 的关系式为: ( )
A: B: C:不能确定 D: 7.对理想气体反应 CO(g) + H2O(g) = H2(g) + CO2(g) ,下述哪种关系是正确的? ( )
A:Kx< Kp B:Kp= Kx C:Kp< Kc D:Kx= Kc 8.若298 K时,反应 的 ,则当p(N2O4)=p(NO2)=1 kPa时,反应将 ( )
A:反应恰好达到平衡 B:不能判断其进行的方向 C:向生成NO2方向进行 D:向生成N2O4方向进行 9.理想气体化学反应平衡时,应用下列哪个关系式? ( )
A:ΔrG = -RTlnKx B:ΔrGm= -RTlnK C:ΔrG = -RTlnK D:ΔrG = -RTlnK 10.已知分解反应 NH2COONH4(s) = 2NH3(g) + CO2(g) 在30℃时的平衡常数K= 6.55×10-4,则此时NH2COONH4(s)的分解压力为: ( )
A:16.63×103 Pa B:594.0×103 Pa C:5.542×103 Pa D:2.928×103 Pa 11.900℃,时氧化铜在密闭的抽空容器中分解,反应为:2CuO(s) = Cu2O(s) + O2(g), 测得平衡时氧气的压力为1.672 kPa,则其平衡常数Kp为: ( )
A:0.00825 B:0.128 C:7.81 D:0.0165 12.某放热反应在 T=800 K.压力p下进行,达平衡后产物的百分含量是50%,若反应在T=200 K.压力p下进行,平衡时产物的百分含量将: ( )
A:不变 B:不能确定 C:增大 D:减小 13.已知转换反应 α- HgS =β-HgS的ΔrG /Jmol-1=980-1.456 T/K,下列结论中哪一个是正确的? ( )
A:常温时β-HgS 稳定 B:转换熵为 -1.456 JK-1mol-1 C:转换熵为9.80 kJmol-1 D:转换温度为 673 K 14.固体氧化物的分解压(分解反应是吸热的)当温度升高时: ( )
A:分解压不能确定 B:分解压降低 C:分解压恒定 D:分解压增大 15.反应CO(g) + H2O(g) = CO2(g) + H2(g) 在 600℃,100 kPa下达到化学平衡,当压力增大到5000 kPa 时,各气体的逸度系数为:γ(CO2) = 1.90 γ(H2) = 1.10 γ(CO) = 1.23 γ(H2O) = 0.77 则平衡点: ( )
A:无法确定 B:向左移动 C:不移动 D:向右移动 16.一定温度下,一定量的 PCl5(g)在某种条件下的解离度为,改变下列条件,何者可使增大?( )
A:体积不变,通入 Cl2气使压力增大一倍 B:压力不变,通入 N2气使体积增大一倍 C:增加压力使体积缩小一倍 D:体积不变,通入 N2气使压力增大一倍 17.已知反应3O2(g) = 2O3(g) 在25℃时,ΔrH =-280 Jmol-1,则对该反应有利的条件是:( )
A:升温降压 B:降温升压 C:升温升压 D:降温降压 18.化学反应体系在等温等压下发生Δξ= 1 mol 反应,所引起体系吉布斯自由能的改变值
ΔrGm的数值正好等于体系化学反应吉布斯自由能 (G/ξ)T,p, 的条件是:( )
A:反应物处于标准状态 B:反应达到平衡 C:无穷大体系中所发生的单位反应 D:体系发生单位反应 19.在恒温恒压下,化学反应 a A + b B = l L + m M 的ΔrGm所代表的意义在下列说法中哪种是错误的? ( )
A:ΔrGm表示有限物系中反应进行时产物与反应物间的吉氏自由能之差(即终态与始态的自由能之差) B:ΔrGm代表变化率(G/)T,p ,即表示在 G-图上反应进度为时的曲率线斜率 C:ΔrGm表示若维持各反应物化学势不变时发生一个单位反应时的吉布斯自由能变化 D:ΔrGm表示有限的反应物系处于该反应进度时的反应倾向 1.某电池反应为 2 Hg(l)+O2+2 H2O(l)=2 Hg2++4 OH -,当电池反应达平衡时,电池的电动势 E 必然是( )。
A:E =E B:E =0 C:E <0 D:E >0 2. 有两个电池:Pt│H2(p
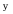 )│KOH (0.1 mol·kg-1)│O2(p
)│KOH (0.1 mol·kg-1)│O2(p 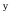 )│Pt 和 Pt │H2(p
)│Pt 和 Pt │H2(p 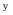 )│H2SO4 (0.0l mol·kg-1)│O2(p
)│H2SO4 (0.0l mol·kg-1)│O2(p 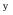 )│Pt 电动势分别为E1和E2 ,比较其电动势大小为( )。
)│Pt 电动势分别为E1和E2 ,比较其电动势大小为( )。A:E1= E2 B:E1> E2 C:E1< E2 D:不能确定 3.电池在 298 K,标准压力下,可逆放电的热效应为–100J,则该电池反应的ΔrHm值应为( )。
A:–100J B:大于100J C:小于–100J D:100J 4.298K时,已知
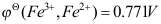 ,
,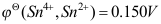 ,则反应2Fe3++Sn2+ = 2Fe2+ + Sn4+ (所有活度均为1)的ΔrGm0为(单位是kJ/mol)( )。
,则反应2Fe3++Sn2+ = 2Fe2+ + Sn4+ (所有活度均为1)的ΔrGm0为(单位是kJ/mol)( )。A:119.9 B:–268.7 C:–177.8 D:–119.9 5.298K时,要使下列电池成为自发电池, Na(Hg)(a1)|Na+(aq)| Na(Hg)(a2)则必须使两个活度的关系为( )。
A:a1= a2 B:a1> a2 C:a1< a2 D:a1和a2可取任意值 6.已知Tl3+, Tl+|Pt的电极电势
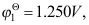 Tl+|Tl的
Tl+|Tl的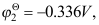 则电极Tl3+|Tl的电极电势为( )。
则电极Tl3+|Tl的电极电势为( )。A:0.305V B:0.914V C:0.721V D:1.586V 7.一个化学反应进行时,ΔrGm = –220.0 kJ/mol。如将该化学反应安排在电池中进行,则需要环境对系统做功。 ( )
A:错 B:对 8.电池反应的电动势E与指定电池反应计量方程式的书写无关,而电池反应的热力学函数变
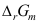 则与指定电池反应计量方程式的书写有关。( )
则与指定电池反应计量方程式的书写有关。( )A:对 B:错 9.电解池通过lF电量时,可以使1mol物质电解。 ( )
A:错 B:对 10.原电池在定温、定压可逆的条件下放电时,DG =0。( )
A:对 B:错 1. 一密闭的容器处于恒温环境,容器内有两杯液体,A杯为纯水,B杯为蔗糖水溶液,静置足够长时间后,观察其变化,发现( )。
A:B杯体积减少 B:B杯体积增加 C:A杯体积减少 D:A杯体积增加 2.常压下,糖水的沸点( )373K。
A:无法确定 B:等于 C:大于 D:小于 3.常压下,糖水的凝固点( )273K。
A:等于 B:小于 C:大于 D:无法确定 4. 偏摩尔量因为与浓度有关,所以它不是一个强度性质。( )
A:错 B:对 5.系统的容量性质才有偏摩尔量。( )
A:对 B:错 6.溶液中溶质B的浓度越大,渗透压越小。( )
A:对 B:错 7.溶液中溶质B的分子量越大,渗透压越大。( )
A:对 B:错 8.偏摩尔量就是化学势。( )
A:错 B:对 9.在100oC,101.325 kPa下液态水的化学势为μ1, 100 oC,150 kPa下水蒸汽的化学势为μ2 ,则μ1 < μ2。( )
A:对 B:错 10.在一定T、P下,多相平衡的条件是任一组分B在各相中的化学势相等。( )
A:错 B:对 1.反应
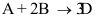 的反应速率
的反应速率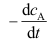 等于_______。( )
等于_______。( )A:
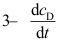 B:
B: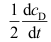 C:
C: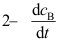 D:
D: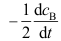 2.某二级反应,反应物消耗
2.某二级反应,反应物消耗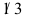 需时间
需时间 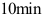 ,若再消耗
,若再消耗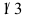 还需时间为______。( )
还需时间为______。( )A:
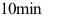 B:
B: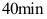 C:
C: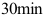 D:
D: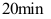 3.在平行反应中要提高活化能较低的反应的产率,应采取的措施升高反应温度( )
3.在平行反应中要提高活化能较低的反应的产率,应采取的措施升高反应温度( )A:对 B:错 4.平行反应
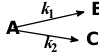
巳知
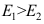 ,设两反应的指前因子相等。当温度不断升高时,最后则有
,设两反应的指前因子相等。当温度不断升高时,最后则有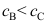 。( )
。( )A:错 B:对 5.有关基元反应的描述在下列诸说法中哪一个是不正确的_______。( )
A:基元反应不一定符合质量作用定律 B:基元反应的反应级数一定是正整数 C:基元反应是“态-态”反应的统计平均结果 D:基元反应进行时无中间产物,一步完成 1.
当克-克方程应用于凝聚相转变为蒸气时,则
A:p必随T之升高而降低
B:p必不随T而变
C:p随T之升高可变大也可减小
D:p必随T之升高而升高
2.
在多相平衡系统中,杠杆规则适用于二组分系统的任何相区。
A:对 B:错 3.
对于恒沸混合物的描述,下列各种叙述中不正确的是
A:恒沸点随外压的改变而改变 B:与化合物一样,具有确定的组成 C:平衡时,气相和液相的组成相同 D:不具有确定的组成
4.
当水处在三相点平衡时,系统发生绝热膨胀,温度降低0.1K,水的相态将如何变化?
A:自由度数减少
B:相数增加 C:相数减少 D:自由度数增加
E:气相消失,液相、固相共存
5.
下列叙述中正确的是:
A:水的三相点f=0,而冰点f=1
B:水的冰点温度是0 oC(273.15 K),压力是101325 Pa
C:三相点的温度和压力仅有系统决定,不能任意改变
D:水的三相点的温度是273.15K,压力是610.62 Pa
6.
对于二组分气—液平衡系统,哪一个可以用蒸馏或精馏的方法将两个组分分离成纯组分?
A:对拉乌尔定律产生最大正偏差的双液系
B:接近于理想的液体混合物 C:部分互溶的双液系
D:对拉乌尔定律产生最大正负差的双液系 7.
在双组分体系T-X图上,若有一极小点,则该点
A:在该点气液两相的量相同
B:叫最低恒沸混合物
C:所对应的组成在任何情况下都不发生变化
D:叫最高恒沸混合物
8.
关于杠杆规则的适用性,下列说法错误的是
A:适用于三组分体系中的两个平衡相
B:适用于二组分体系的两相平衡区
C:适用于二组分体系相图中的任何区
D:适用于单组分体系的两个平衡相 E:适用于三相平衡线上的任意两个平衡相 9.
N2的临界温度是124 K,如果想要液化N2就必须:
A:在恒压下升高温度 B:在恒压下降低温度 C:在恒温下增加压力 D:在恒温下降低压力 10.
某一水溶液中有 n种溶质,其摩尔分数分别是 x1,x2,...,xn,若使用只允许水出入的半透膜将此溶液与纯水分开,当达到渗透平衡时水面上的外压为 pw,溶液面上外压为 ps,则该体系的自由度数为:
A: f=n+1 B: f=n+3 C: f=n D:f=n+2 1.电解质溶液的摩尔电导率可以看成是正负离子摩尔电导率之和,这一规律只适用于( )
A:无限稀溶液
B:浓度为 1mol/m3时的溶液
C:弱电解质
D:强电解质
2.相同浓度的KCl, KOH, HCl 稀溶液,按它们摩尔电导率大小排序,应是( )
A:KOH> KCl> KCl
B:HCl> KOH> KCl
C:HCl> KCl > KOH
D:KCl> KOH> HCl
3.法拉第定律适用于所有液态和固态导电物质。( )
A:错 B:对 4.
一个原电池有两个电极,相对而言,电势高的电极称为正极;电势低的电极称为负极 。
A:对 B:错 5.
一定温度下的KCl水溶液,当KCl物质的量浓度无限趋近于零时,KCl水溶液的电导率κ与KCl的摩尔电导率Λm在数值上相等。( )
A:错 B:对







