第二章测试1. 某液体物质在恒温恒压下蒸发为蒸气,过程的△U ( )
A:=0 B:<0 C:无法确定 D:>0
答案:D
2. 下列不符合绝热可逆过程方程式的为( )
A:
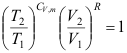 B:
B: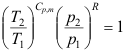 C:
C: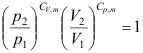 D:
D: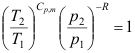 3. 298.15K时,反应2Ag2O = 4Ag(s)+O2(g)的
3. 298.15K时,反应2Ag2O = 4Ag(s)+O2(g)的 ,则同温下
,则同温下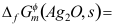 ( )kJ·mol-1。
( )kJ·mol-1。A:-11.20 ; B:11.20 ; C:22.40 ; D:-22.40。 4. 1 mol单原子理想气体从始态298 K、200kPa,经绝热可逆膨胀使体积加倍,则终态温度为( )
A:48 K B:393.2 K C:225.8 K D:187.7 K 5. 理想气体在等温自由膨胀过程中,下列答案正确的是( )
A:W < 0 B:Q > 0 C:△H = 0。 D:△U > 0 6. 不论是否理想气体,内能与焓都只是温度的函数。( )
A:对 B:错 7.
当环境压力为零时,气体发生自由膨胀过程没有与环境发生体积功的交换。( )
A:对 B:错 8. 盖斯定律指出恒容热或恒压热只取决于过程的始末态,与途径无关。( )
A:错 B:对 9. 焓的定义式H=U+pV是在定压条件下推导出来的,所以只有定压过程才有焓变。( )
A:对 B:错 1.某绝热体系在接受了环境所做的功之后,其温度( )。
A:一定不变 B:一定升高 C:不一定改变 D:一定降低 2.对于封闭体系,当过程的始终态确定后,下列值中不能确定的是( )。
A:可逆过程的W B:恒容、无其它功过程的Q C:绝热过程的W D:任意过程的Q+W 3.下面陈述中,不正确的是( )。
A:热量是由于温度差而传递的能量,它总是倾向于从含热量较多的高温物体流向含热量较少的低温物体 B:封闭系统与环境之间交换能量的形式非功即热 C:两物体之间只有存在温差,才可传递能量,反过来系统与环境间发生热量传递后,必然要引起系统温度变化功可以全部转化为热,但热不能全部转化为功。 D:虽然Q和W是过程量,但由于QV=∆U,而U和H是状态函数,所以QV和QP是状态函数 4.功可以全部转化为热,但热不能全部转化为功。( )
A:错 B:对 5.完成同一过程,经任意可逆途径所做的功不一定比经任意不可逆途径所做的功多。( )
A:错 B:对 1.理想气体与温度为的大热源接触作等温膨胀,吸热,所作的功是变到相同终态的最大功的20%,则体系的熵变为( )。
A:5/
B:0
C:/
D:-/
2.某化学反应在300K、下于烧杯中进行,放热60 kJ·mol,若在相同条件下安排成可逆电池进行,吸热6 kJ·mol,反应在试管中进行时其环境的熵变为( )。
A:-180 J·K·mol
B:200 J·K·mol
C:180 J·K·mol
D:-200 J·K·mol
3.可逆机的效率最高,在其它条件相同的情况下假设由可逆机牵引火车,其速度将( )。
A:中等
B:最快
C:最慢
D:不确定
4.
水处于图中曲线最低点(A点)所指状态 ,则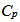 与
与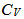 的关系为( )。
的关系为( )。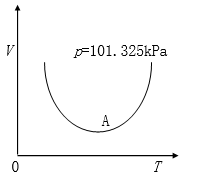
A:
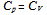
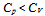
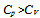
5.在 270 K、101.325 kPa 下,1 mol过冷水经等温等压过程凝结为同样条件下的冰,则体系及环境的熵变应为:( )。
A:Δ(体系)< 0 , Δ (环境)< 0
B:Δ (体系)< 0 , Δ (环境)> 0
C:Δ (体系)> 0 , Δ (环境)> 0
D:Δ (体系)> 0 , Δ (环境)< 0
6.
由纯物质形成理想液态混合物有( )。
A:
ΔmixS = 0
B:ΔmixG= 0
C:ΔmixH = 0
D:ΔmixV≠ 0
1.已知焓的定义式为:H=U+PV,体系状态发生变化后,则有ΔH =ΔU +Δ(PV),此时ΔH >ΔU一定成立。( )A:错 B:对 2.状态确定后,状态函数的值即被确定。( )
A:错 B:对 3.系统状态改变后,状态函数得值一定都改变。( )
A:对 B:错 4.理想气体绝热向真空膨胀,ΔU=0,Q=0。( )
A:错 B:对 5.根据热力学第一定律,因为能量不会无中生有,所以一个系统如要对外做功,必须从环境吸收热量。( )
A:错 B:对 6.某理想气体的γ=Cp/CV =1.40 ,则该气体为几原子分子?( )
A:三原子分子 B:双原子分子 C:单原子分子 D:四原子分子 7.涉及焓的下列说法中正确的是 ( )
A:在等温过程中焓变为零 B:焓的增量只与系统的始态、终态有关 C:化学反应中,系统的焓变不一定大于内能变化 D:在绝热可逆过程中焓变为零 8.凡是在孤立体系中进行的变化,其ΔU 和ΔH 的值一定是: ( )
A:ΔU =0,ΔH不能确定。 B:ΔU >0,ΔH >0 C:ΔU <0,ΔH <0 D:ΔU=0,ΔH =0 9.
某化学反应在恒压、绝热和只作体积功的条件下进行,体系温度由T1升高到T2,则此过程的焓变ΔH:( )
A:等于零 B:不能确定
C:小于零 D:大于零 10.当以5 mol 氢气与4 mol 氯气混合,最后生成2 mol HCl气体。若计量方程式如下:
H2(g) + Cl2(g)→ 2HCl(g),则反应进度ξ应是( )。
A:1 mol B:2 mol C:4 mol D:5 mol 11.从同一始态到达同一末态,经不同的可逆途经所做的功都一样多。 ( )
A:错 B:对 12.完成同一过程,经不同的不可逆途经所做的功都一样多。 ( )
A:对 B:错 13.非理想气体,经历一个不可逆循环,其ΔU、ΔH均一定为零。( )
A:对 B:错 1.
恒温恒压条件下,某化学反应若在电池中可逆进行时吸热,据此可以判断下列热力学量中何者一定大于零
A: ΔU B: ΔH C: W D:ΔS 2.
从始态A经某一过程到达终态B,则dS=
A:Q/T B:(Q/T)R (R代表可逆过程) C:(Q/T) D: 0 3.
任意体系经一循环过程, ΔU,ΔH,ΔS均为零,此结论对吗?
A:对 B:错 4.
用 1 mol 理想气体进行焦耳实验(自由膨胀),求得 ΔS = 19.16 J· K-1,则体系的吉布斯自由能变化为:
A: ΔG < 19.16 J B: ΔG > 19.16 J C:ΔG = 19.16 J D: ΔG = 0 5.
封闭体系中,若某过程的ΔA = 0,应满足的条件是:
A: 等容等压,且 Wf = 0 的过程 B:等温等容,且 Wf = 0 的可逆过程 C:绝热可逆,且 Wf = 0 的过程 D: 等温等压,且 Wf = 0 的可逆过程 6.
1×10-3 kg 水在 373 K,101 325 Pa 的条件下汽化为同温同压的水蒸气,热力学函数变量为 ΔU1,ΔH1和 ΔG1;现把 1×10-3 kg 的 H2O(温度、压力同上)放在恒 373 K 的真空箱中,控制体积,体系终态蒸气压也为101 325 Pa,这时热力学函数变量为ΔU2,ΔH2和 ΔG2。问这两组热力学函数的关系为
A:ΔU1> ΔU2, ΔH1> ΔH2, ΔG1> ΔG2 B:ΔU1< ΔU2, ΔH1< ΔH2, ΔG1< ΔG2 C:ΔU1= ΔU2, ΔH1> ΔH2, ΔG1= ΔG2 D:ΔU1= ΔU2, ΔH1= ΔH2, ΔG1= ΔG2 7.
恒压下纯物质当温度升高时其吉布斯自由能:
A:下降 B: 不变 C: 上升 D: 无法确定 8.
下列不属于(¶G/¶p)T,n= (¶H/¶p)S,n,的使用条件的是
A:等熵过程 B: 任何热力学均相平衡体系 , Wf = 0 C:等温过程 D: 等温等熵过程 9.
理想气体向真空膨胀,体积由V1变到V2,其ΔU =0 ,ΔS >0,对吗
A:错 B:对 10.
凡是ΔS > 0 的过程都是不可逆过程,对吗?
A:错 B:对 1.卡诺热机在500 K的高温热源和300 K的低温热源间工作,其热机的效率为( )
A:60%
B:80%
C:40%
D:20%
2.1mol 冰在273K,101325Pa下熔化为水的熵变为( )J · K-1,已知冰的熔化热为6008 J · mol-1。
A:-22
B:22
C:35
D:-35
3.溶液的冰点降低和沸点升高均源于凝固点降低( )
A:对 B:错 4.用亥姆霍兹自由能变作为判据的条件是定温、定容、非体积功为零。( )
A:对 B:错 5.自发过程一定是不可逆的,故不可逆过程一定是自发的。( )
A:对 B:错 1.对于孤立体系中发生的实际过程,下列各式中不正确的是: ( )
A:ΔH = 0 B:ΔS > 0 C:W = 0 D:Q = 0 2.熵变S是: (1) 不可逆过程热温商之和; (2) 可逆过程热温商之和; (3) 与过程无关的状态函数; (4) 与过程有关的状态函数; 以上正确的是: ( )
A:1,2 B:2 C:2,3 D:4 3.1 mol 理想气体在室温下进行恒温不可逆膨胀 (Q = 0 ),使体系体积增大一倍,则有:
ΔS体系/J·K-1·mol-1 ; ΔS环境/J·K-1·mol-1 ; ΔS隔离/J·K-1·mol-1 ( )
A:0 0 0 B:5.76 0 5.76 C:0 5.76 5.76 D:5.76 - 5.76 0 4.1 mol理想气体向真空膨胀,若其体积增加到原来的10倍,则体系.环境和孤立体系的熵变应分别为: ( )
A:-19.14 J·K-1, 19.14 J·K-1 , 0 B:19.14 J·K-1, 0 , 19.14 J·K-1 C:19.14 J·K-1, -19.14 J·K-1 , 0 D:0 , 0 , 0 5.固体碘化银(AgI)有α和β两种晶型,这两种晶型的平衡转化温度为419.7 K,由α型转化为β型时,转化热等于6462 J·mol-1,由型转化为β型时的S应为: ( )
A:15.4 J B:-15.4 J C:44.1 J D:-44.1 J 6.在绝热恒容的反应器中,H2和 Cl2化合成 HCl,此过程中下列各状态函数的变化值哪个为零? ( )
A:ΔrHm B:ΔrSm C:ΔrGm D:ΔrUm 7.理想气体恒压膨胀,其熵值如何变化? ( )
A:增大 B:不能确定 C:不变 D:减小 8.恒温恒压条件下,某化学反应若在电池中可逆进行时吸热,据此可以判断下列热力学量中何者一定大于零? ( )
A:ΔS B:ΔH C:ΔG D:ΔU 9.在p $,273.15 K下水凝结为冰,判断体系的下列热力学量中何者一定为零? ( )
A:ΔH B:ΔS C:ΔG D:ΔU 10.纯液体苯在其正常沸点等温汽化,则: ( )
A:ΔvapU$=ΔvapH$,ΔvapF$=ΔvapG$,ΔvapS$> 0 B:ΔvapU$>ΔvapH$,ΔvapF$>ΔvapG$,ΔvapS$< 0 C:ΔvapU$<ΔvapH$,ΔvapF$<ΔvapG$,ΔvapS$> 0 D:ΔvapU$<ΔvapH$,ΔvapF$<ΔvapG$,ΔvapS$< 0 11.273 K,2×101.3 kPa 时,水的化学势比冰的化学势: ( )
A:相等 B:高 C:低 D:不可比较 12.下列公式中哪一个适用于一切体系: ( )
A:dS = -(V/T)pdp B:dS = Qr/T C:dS = deS + diS D:dS = dS体+ dS环 13.101.325 kPa,-5℃ 时,H2O(s) H2O(l),其体系熵变: ( )
A:ΔfusS体系 < 0 B:ΔfusS体系 ≤ 0 C:ΔfusS体系 = 0 D:ΔfusS体系 > 0 14.3 kPa下,110℃的水变为110℃水蒸气,吸热Qp,在该相变过程中下列哪个关系式不成立? ( )
A:S环不确定 B:S体+S环> 0 C:S环< 0 D:S体> 0 15.理想气体经绝热可逆膨胀至一定的终态,该过程中体系的熵变ΔS体 及环境的熵变ΔS环应为: ( )
A:ΔS体>0,ΔS环<0 B:ΔS体=0,ΔS环=0 C:ΔS体>0,ΔS环=0 D:ΔS体<0,ΔS环>0 16.下列关系式中哪个不需要理想气体的假设? ( )
A:(dlnp)/dT =ΔH/RT2 B:Cp- CV = nR C:对恒压过程,ΔH =ΔU + pΔV D:对绝热可逆过程,pV= 常数。 17.理想气体在绝热条件下,经恒外压压缩至稳定,此变化中的体系熵变S体及环境熵变S环应为: ( )
A:S体< 0 , S环> 0 B:S体< 0 , S环= 0 C:S体> 0 , S环< 0 D:S体> 0 , S环= 0 18.某化学反应在300 K, p下于烧杯中进行,放热 60 kJ·mol-1,若在相同条件下安排成可逆电池进行,吸热 6 kJ·mol-1,则该体系的熵变为: ( )
A:–200 J·K-1·mol-1 B:–20 J·K-1·mol-1 C:200 J·K-1·mol-1 D:20 J·K-1·mol-1 19.单原子分子理想气体的CV, m =(3/2)R,温度由T1变到T2时,等压过程体系的熵变ΔSp与等容过程熵变ΔSV之比是: ( )
A:3 : 5 B:2 : 1 C:1 : 1 D:5 : 3 1.
系统达到平衡时,熵值最大,吉布斯自由能最小。( )
A:对 B:错 2.
热力学第三定律可以表述为:在0℃时,任何完整晶体的熵等于零。( )
A:对 B:错 3.
对于不做非体积功的隔离系统,熵判据为:( )
A: (dS) p,V ≥ 0 B: (dS) p,U ≥ 0 C:
(dS)T,U ≥ 0
D:(dS) U, V ≥ 0 4.封闭体系中,若某过程的ΔG = 0,应满足的条件是: ( )
A:等温等压,且 Wf = 0 的可逆过程 B:等温等容,且 Wf = 0 的可逆过程 C:等容等压,且 Wf = 0 的过程 D:
绝热可逆,且 Wf = 0 的过程
5.在270K 和大气压力下,一定量的过冷水凝结为同温同压的冰,则系统和环境的熵变分别为( )
A:DSsys < 0, DSsur > 0 B:DSsys > 0, DSsur > 0 C:DSsys > 0, DSsur < 0 D:DSsys < 0, DSsur < 0 6.
单原子分子理想气体的CV,m=3/2R,温度由 T1 变到 T2 时,等压过程系统的熵变 ΔSp 与等容过程熵变 ΔSV 之比为 ( )
A:1:1 B:3:5 C:2:1 D:5:3 7.
公式 dG = -SdT + Vdp 可适用下述哪一过程: ( )
A:理想气体真空膨胀 B:
N2(g) + 3H2(g)=2NH3(g) 未达平衡
C:电解水制取氢 D:298K、101325Pa 下的水蒸发过程
8.从热力学基本关系式可导出 (¶U/¶S)V 等于: ( )
A:(¶A/¶V)T B:(¶G/¶T)p C:(¶H/¶S)p D:(¶U/¶V)S 9.
纯液体苯在其正常沸点等温汽化,则: ( )
A:ΔvapU$ > ΔvapH$,ΔvapA$ > ΔvapG$,ΔvapS$< 0 B:ΔvapU$ < ΔvapH$,ΔvapA$< ΔvapG$,ΔvapS$ < 0 C:
ΔvapU$ = ΔvapH$,ΔvapA$ = ΔvapG$,ΔvapS$ >0
D:ΔvapU$ < ΔvapH$,ΔvapA$< ΔvapG$,ΔvapS$ > 0
10.2 mol H2和 2 mol Cl2在绝热钢筒内反应生成 HCl 气体,起始时为常温常压。则:( )
A:ΔrU < 0,ΔrH < 0,ΔrS > 0,ΔrG < 0 B:
ΔrU = 0,ΔrH = 0,ΔrS > 0,ΔrG < 0
C:ΔrU > 0,ΔrH > 0,ΔrS = 0,ΔrG > 0 D:ΔrU = 0,ΔrH > 0,ΔrS > 0,ΔrG < 0 1.关于循环过程,下列表述正确的是 ( )A:
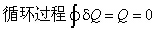
B:循环过程不一定是可逆过程
C:可逆过程一定是循环过程
D:
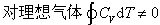
2.关于焓变,下列表述不正确的是 ( )
A:对任何体系等压只作体积功的过程△H =△U – W
B:对实际气体的恒容过程△H = △U + V△p
C:对于常压下的凝聚相,过程中△H ≈△U
D:△H = Q适用于封闭体系等压只作功的过程
3.双原子理想气体,由400 K、14.0 dm3先反抗恒外压绝热膨胀至体积为26.2 dm3,再保持体积不变升温至400 K,则整个过程 ( )
A:Q < –W
B:△H > 0
C:△U < 0
D:Q = –W
4.对封闭体系下列关系不正确的是 ( )
A:
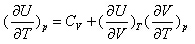
B:
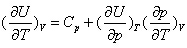
C:
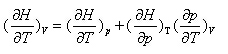
D:
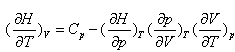
5.一个绝热过程Q = 0,但体系的 DT不一定为零。( )
A:对 B:错 1.PCl5 (g)= PCl3(g)+Cl2(g)在473K达到平衡时,PCl5 (g)有48.5%分解,在573 K达到平衡时,PCl5 (g)有97%分解,此反应为( )。
A:反应的标准摩尔焓变为零 B:放热反应 C:两温度下的标准平衡常数相等 D:吸热反应 2.设有理想气体反应A(g)+B(g)=C(g),在温度T,体积V的容器中,三个组分的分压分别为PA、PB、 PC时达到平衡,如果在T、V恒定时,注入物质的量为n的惰性气体,则平衡将( )。
A:不移动 B:向右移动 C:向左移动 D:不能确定 3.将20克CaCO3(s)和60克CaCO3(s)分别放入抽真空、同容积的A容器和B容器中,且与同一定温热源相接触,达到化学平衡时CaCO3(s)部分分解为CaO(s)和CO2(g),若忽略固体体积,则两容器中CaCO3(s) 分解量为( )。
A:A容器中的多 B:不能 C:B容器中的多 D:一样多 4.
影响任一化学反应的标准平衡常数的因素是( )。
A:催化剂 B:其余三个答案均对 C:温度 D:压力 5.有二个反应:(1)SO2(g)+
则K1Θ与K2Θ的关系是( )。
A:2K1Θ= K2Θ B:(K1Θ)2= K2Θ C:K1Θ= (K2Θ)2 D:K1Θ= K2Θ 6.已知反应2NH3 = N2 + 3H2的标准平衡常数为0.25,同一条件下反应
A:1 B:0.5 C:2 D:4 7.标准平衡常数改变,平衡一定会移动。反之,平衡移动,标准平衡常数也一定会改变。( )
A:错 B:对 8.任何一个化学反应都可以用
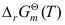 来判断反应的方向。( )
来判断反应的方向。( )A:错 B:对 9.标准态下的化学反应达到平衡时,
A:对 B:错 10.理想气体反应,等温等容条件下添加惰性组分时,平衡将向体积减小的方向移动。( )
A:错 B:对 1.在263 K时过冷水凝结成263 K的冰,则( )
A:ΔSsys<0 B:ΔSsys=0 C:无法确定 D:ΔSsys>0 2.在绝热条件下,迅速推动活塞压缩气筒内空气,此过程的熵变 ( )
A:无法确定 B:小于零 C:大于零 D:等于零 3.体系由初态 A 经不同的不可逆途径到达终态B时其熵变ΔS ( )
A:不一定相同 B:不等于经可逆途径的熵变 C:都相同 D:各不相同 4.吉布斯自由能的含义应该是 ( )
A:是体系能对外做非体积功的能量 B:是在恒温恒压条件下体系能对外做非体积功的能量 C:按定义理解 G=H-TS D:是在可逆条件下体系能对外做非体积功的能量 5.熵变ΔS是: (1) 不可逆过程热温商之和 (2) 可逆过程热温商之和 (3) 与过程无关的状态函数 (4) 与过程有关的状态函数,以上说法正确的是 ( )
A:2,3 B:2 C:4 D:1,2 6.理想气体的等温膨胀过程,∆U=0,系统所吸的热全部变为功,这与Kelvin的说法不符。( )
A:对 B:错 7.在一个绝热系统中,发生了一个不可逆过程,系统从状态1变到了状态2,不论用什么方法,系统再也回不到原来状态了。 ( )
A:错 B:对 8.不可逆过程一定是自发的,而自发过程一定是不可逆的。( )
A:对 B:错 9.系统达到平衡时,熵值最大,吉布斯自由能最小。( )
A:错 B:对 10.冷冻机可以从低温热源吸热放给高温热源,这与Clausius的说法不符。( )
A:错 B:对 1.下列叙述不正确的是( )。
A:不可逆过程发生的实质都归结于能量品位的降低 B:一个不可能进行的过程假设已经进行,必将使能量的品位升高 C:凡是不违背能量守恒原理的过程都能发生 2.关于可逆过程,以下叙述不正确的是( )。
A:可逆过程是可以简单逆转完全复原的过程 B:在同样的平衡条件下,正逆过程都能任意进行 C:无限接近平衡的条件下进行的过程 3.已知低温热源T2是高温热源T1的0.6倍,则其间运转的可逆热机
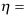 ( )。
( )。A:0.5 B:0.4 C:0.6 4.克劳修斯不等式
 表示的意义不正确的是( )。
表示的意义不正确的是( )。A:小于零:过程逆向进行 B:大于零:是不可逆过程,可以进行,过程的方向是可能的 C:等于零:是可逆过程,是极限,系统处于平衡 5.绝热不可逆过程中,系统(Sys)与环境(Sur)的熵变,正确的是( )。
A:
 B:
B: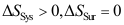 C:
C: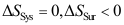 6.在一绝热恒容的系统中发生了一个爆炸反应,系统的温度和压力都升高了,以下结论正确的是( )。
6.在一绝热恒容的系统中发生了一个爆炸反应,系统的温度和压力都升高了,以下结论正确的是( )。A:
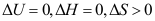 B:
B: C:
C: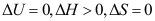 7.
7.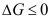 作为过程的可逆性判据,其适用条件是( )。
作为过程的可逆性判据,其适用条件是( )。A:恒温 B:恒温恒容和只做体积功 C:恒温恒压和只做体积功 8.已知H2O(l)的标准摩尔生成焓为
 ,标准摩尔生成吉氏函数为
,标准摩尔生成吉氏函数为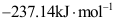 。若H2O的生成反应在一很大的电池中可逆进行,且=1mol。以下理解有错误的是( )。
。若H2O的生成反应在一很大的电池中可逆进行,且=1mol。以下理解有错误的是( )。A:与外界交换的热量为285.85kJ B:对外做的电功为237.14kJ C:对外做的电功为285.85kJ 9.在-5℃的环境中,将0℃、101325Pa的水凝固成0℃、101325Pa的冰,则此过程的
 ( )0。
( )0。A:> B:= C:< 10.对于
A:
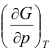 B:
B: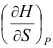 C:
C: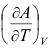 11.
11.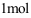 理想气体的
理想气体的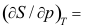 ( )。
( )。A:
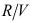 B:
B: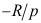 C:R
12.根据
C:R
12.根据 和
和 ,正确描述纯物质G与温度T关系的曲线是( )。
,正确描述纯物质G与温度T关系的曲线是( )。
A:黄色与黑色线 B:蓝色线 C:红色线 13.对于理想气体,式
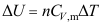 ( )。
( )。A:仅适用于恒容过程 B:仅适用于恒压过程 C:适用于一切过程 14.一理想气体反抗外压100kPa作等温膨胀,则( )。
A:W>0,
 = 0,Q<0
B:W<0,
= 0,Q<0
B:W<0,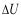 = 0,Q>0
C:W=0,
= 0,Q>0
C:W=0,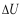 = 0,Q=0
15.p-V图上有一条可逆绝热线和一条恒温线,下列说法正确的是( )。
= 0,Q=0
15.p-V图上有一条可逆绝热线和一条恒温线,下列说法正确的是( )。A:两者不可能相交 B:恒温线比可逆绝热线陡 C:可逆绝热线比恒温线陡 16.1mol氮气和另外2mol氮气在恒温恒压下混合,则混合熵变( )。
A:大于零 B:等于零 C:小于零 17.已知
 。某一气体的方程为
。某一气体的方程为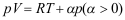 ,经恒熵膨胀后,其温度( )。
,经恒熵膨胀后,其温度( )。A:必定降低 B:必定升高 C:不变 18.已知某可逆反应的
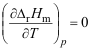 ,则当温度降低时其熵
,则当温度降低时其熵 ( )。
( )。A:减小 B:不变 C:增大 19.当以5molH2气与4molCl2气混合,最后生成2molHCl气。若反应按下式进行,
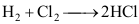 ,则反应进度ξ应是( )。
,则反应进度ξ应是( )。A:4 mol B:1 mol C:5 mol D:2 mol 20.
 称为克拉佩龙—克劳修斯方程。下列说法正确的是( )。
称为克拉佩龙—克劳修斯方程。下列说法正确的是( )。A:该方程适用于水的相图中的各条平衡线 B:该方程只适用于水的相图中的液固平衡线 C:该方程只适用于水的相图中的气液平衡线







