第一章测试1.1887年德国科学家W.Ostwald和荷兰科学家J.H.van’t Hoff 合办的《物理化学杂志》 (德文)创刊是物理化学学科形成的标志。( )
A:对 B:错
答案:A
2.物理化学中对一个物理量的表示需要包括数值和单位,但在作图列表时使用纯数来表示。( )
A:对 B:错
答案:A
3.物理化学中的量值计算只需要将对应物理量的数值带入公式进行计算即可。( )
A:错 B:对
答案:A
1.有一真空绝热瓶子,通过阀门和大气隔离,当阀门打开时,大气(视为理想气体)进入瓶内,此时瓶内气体的温度将( )。
A:降低
B:不变
C:升高
D:不定
答案:C
2.范氏气体经Joule实验后(绝热向真空绝热膨胀)气体的温度将( )。
A:上升
B:不变
C:下降
D:不确定
答案:C
3.在下,C(石墨) + O (g)─→CO(g) 的反应热为Δ,下列哪种说法是错误的?( )。
A:Δ是CO(g)的标准生成热
B:Δ是石墨的燃烧热
C:Δ=Δ
D:Δ>Δ
答案:C
4.
在等压下,无论用什么手段进行一个A+B=C的反应,若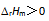 ,则该反应一定为( )。
,则该反应一定为( )。
A:无热量变化
B:吸热反应
C:视反应手段而定
D:放热反应
答案:C
5.
物质的量为n的纯理想气体,该气体的哪一组物理量确定后,其它状态函数方有定值( )。
A:T、U B:T、p C:V D:p
答案:B
1.从宏观到微观不是近代化学的发展趋势。( )
A:对 B:错
答案:B
2.近代化学突出的特点之一是介观化学发展迅速。( )
A:对 B:错
答案:A
3.多相催化反应总是在固体表面上进行的。( )
A:错 B:对
答案:B
4.热力学研究方法是物理化学特殊的研究方法之一。( )
A:对 B:错
答案:A
5.同学们学习物理化学时应当关注公式和定律的适用条件。( )
A:错 B:对
答案:B
1.凝固热在数值上与下列哪一种热相等:( )。
A:升华热 B:汽化热 C:溶解热 D:熔化热
答案:D
2.完全燃烧 8 dm3乙炔需多少体积的空气? ( )。
A:120 dm3 B:20 dm3 C:4 dm3 D:100 dm3
答案:D
3.298 K时,石墨的标准摩尔生成焓ΔfH :( )。
A:小于零 B:不能确定 C:等于零 D:大于零
答案:C
4.石墨(C)和金刚石(C)在 25℃, 101 325 Pa下的标准燃烧焓分别为-393.4 kJ·mol-1和-395.3 kJ·mol-1,则金刚石的标准生成焓ΔfH (金刚石, 298 K)为: ( )。
A:1.9 kJ·mol-1 B:-1.9 kJ·mol-1 C:-393.4 kJ·mol-1 D:-395.3 kJ·mol-1
答案:A
5.Cl2(g)的燃烧热为何值? ( )。
A:HClO3的生成热 B:HClO4的生成热 C:Cl2(g)生成盐酸水溶液的热效应 D:HCl(g)的生成热
答案:C
6.当体系传热给环境之后,其焓值: ( )。
A:都不一定 B:必定增加 C:必定减少 D:必定不变
答案:A
7.非理想气体进行绝热自由膨胀时,下述答案中哪一个错误? ( )
A:Q=0 B:ΔH=0 C:ΔU=0 D:W=0
答案:B
8.下述哪一种说法正确? 因为ΔHp = Qp,所以:( )。
A:恒压过程中, ΔU不一定为零 B:恒压过程中,焓变不能量度体系对外所做的功 C:恒压过程中,焓不再是状态函数 D:恒压过程中,体系与环境无功的交换
答案:A
9.在非等压过程中加热某体系, 使其温度从T1升至T2, 吸热Q, 则此过程的焓增量ΔH 为: ( )。
A:ΔH=0 B:ΔH等于别的值 C:ΔH=Q D:ΔH=U+(pV)
答案:D
10.体系的压力p(体系)与环境的压力p(环境)有何关系? ( )
A:p(体系)>p(环境) B:无关系 C:可逆变化途径中p(体系)=p(环境) D:相等
答案:C
11.下述说法哪一个错误? ( )
A:封闭体系的任一变化与其状态图上的实线一一对应 B:封闭体系的状态与其状态图上的点一一对应 C:封闭体系的状态即是其平衡态 D:封闭体系的任一可逆变化途径都可在其状态图上表示为实线
答案:A
12.凡是在孤立体系中进行的变化,其ΔU和ΔH的值一定是: ( )
A:ΔU = 0 , ΔH = 0 B:ΔU < 0 , ΔH < 0 C:ΔU = 0 , ΔH大于.小于或等于零不确定 D:ΔU > 0 , ΔH > 0
答案:C
13.封闭体系恒压过程中体系吸收的热量Qp等于其焓的增量ΔH ”,这种说法: ( )
A:需加可逆过程与无非体积功的条件 B:正确 C:需增加无非体积功的条件 D:需加可逆过程的条件
答案:C
14.封闭体系中,有一个状态函数保持恒定的变化途径是什么途径? ( )
A:一定是可逆途径 B:体系没有产生变化 C:一定是不可逆途径 D:不一定是可逆途径
答案:D
15.压力为106 Pa的2 m3范德华气体进行绝热自由膨胀,直至体系压力达到5×105 Pa时为止。此变化中,该气体做功为多少? ( )
A:106 J B:0 J C:2×106 J D:105 J
答案:B
16.下列宏观过程:(1) p$, 273 K 下冰融化为水; (2) 电流通过金属发热; (3) 往车胎内打气; (4) 水在 101 325 Pa, 373 K 下蒸发 ; 可看作可逆过程的是: ( )
A:(2),(3) B:(1),(4) C:(1),(3) D:(2),(4)
答案:B
17.理想气体在恒定外压p$下,从10 dm3膨胀到16 dm3,同时吸热126 J。计算此气体的ΔU。 ( )
A:842 J B:-482 J C:482 J D:-284 J
答案:B
18.在体系温度恒定的变化中,体系与环境之间: ( )
A:一定产生热交换 B:不一定产生热交换 C:一定不产生热交换 D:温度恒定与热交换无关
答案:B
1.
对于理想气体的热力学能,有下述4种说法,其中不正确的是( )
A:对应于某一状态的热力学能是可以直接测定的 B:对应于某一状态,热力学能只有一个数值,不可能有两个或两个以上的数值 C:状态改变时,热力学能不一定跟着改变 D:状态一定,热力学能也一定
答案:A
2.
某理想气体的 g =Cp/CV =1.40,则该气体为几原子分子?( )
A:三原子 B:单原子 C:双原子 D:四原子
答案:C
3.
当5 mol H2(g)和4 mol Cl2(g)混合,最后生成2 mol HCl (g)。若以下式为基本单元H2(g)+Cl2(g) =2 HCl (g)。则反应进度x 应是( )
A:4 mol B:2 mol C:5 mol D:1 mol
答案:D
4.
系统发生了一个等温变化,系统与环境之间( )
A:一定没有热交换 B:一定有热交换 C:不一定有热交换 D:等温过程与热交换无关
答案:C
5.
石墨(C)和金刚石(C)在298K、标准压力下的标准燃烧焓分别为-393.4 kJ/mol和 -395.3 kJ/mol,则金刚石的标准摩尔生成焓Df Hm$(金刚石,298 K)为:( )
A:
1.9 kJ/mol
B:-1.9 kJ/mol
C:-395.3 kJ/mol
D:-393.4 kJ/mol
答案:A
6.
有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与筒外压力相等时关闭活塞,此时筒内温度将 ( )
A:不变 B:无法判断 C:降低 D:升高
答案:C
7.
苯在一个刚性的绝热容器中燃烧,C6H6(l) + (15/2)O2(g)→6CO2(g) + 3H2O(g) ,下面正确的是( )
A:
ΔU = 0 , ΔH > 0 , W = 0
B:ΔU ≠ 0 , ΔH ≠ 0 , Q = 0
C:ΔU = 0 , ΔH < 0 , Q = 0
D:ΔU = 0 , ΔH = 0 , Q = 0答案:A
8.
理想气体在恒定外压 p$下,从 10 dm3 膨胀到 16 dm3 ,同时吸热126 J。计算此气体的ΔU 为 ( )
A:
842 J
B:-482 J
C:-284 J
D:482 J
答案:B
9.
一定量的理想气体从同一始态出发,分别经如下两个过程到达相同压力的终态,(1)等温压缩,其焓变为ΔH1,(2)绝热压缩,其焓变为ΔH2,两者之间的关系为( )
A:无法确定 B:ΔH1 > ΔH2 C:ΔH1 = ΔH2 D:ΔH1 < ΔH2
答案:D
1.NH 4HS(s)和任意量的NH 3(g)和H 2S(g)达到平衡时有( )
A:C=1,Φ=3,f=2 B:C=1,Φ=2,f=3 C:C=1,Φ=2,f=1 D:C=2,Φ=2,f=2
答案:D
2.对于恒沸混合物,下列说法中错误的是( )
A:与化合物一样具有确定的组成 B:平衡时气相组成和液相组成相同 C:不具有确定组成 D:其沸点随外压的变化而变化
答案:A
3.对于二组分气液平衡系统,可以用蒸馏或精馏的方法将两个各组分分离成纯组分的是 ( )
A:分互溶的双液系 B:Raoult定律产生最大正偏差的双液系 C:对Raoult定律产生最大负偏差的双液系 D:接近于理想的液体混合物
答案:D
4.将固体NH 4HCO 3(s)放入真空容器中,恒温到400K,NH 4HCO 3(s)按下式分解并达到平衡:NH 4HCO3(s)= NH 3(g)+ H2O(g)+CO 2(g) 体系的组分数C和自由度数f为( )
A:C=3,f=2 B:C=2,f=2 C:C=2,f=1 D:C=1,f=0
答案:D
5.已知纯液体A和B,其沸点分别为T A* =116℃,T B*=80℃,A和B可以形成双组分理想液态混合物,将某一定组成的该液态混合物进行精馏(完全分离)时,则( )
A:在塔中间得到纯B B:无法确定 C:在塔顶得到纯B D:在塔底得到纯B
答案:C
6.在101325Pa下,用水蒸气蒸馏法提纯某不溶于水的有机物时,体系的沸点( )
A:必高于373.2K B:必低于373.2K C:取决于水与有机物的相对数量 D:取决于有机物相对分子量
答案:B
7.面粉和米粉混合得十分均匀,肉眼已无法分清彼此,所以它们已成为一相。( )
A:对 B:错
答案:B
8.一定温度下的乙醇水溶液,可用克-克方程计算其饱和蒸气压。 ( )
A:错 B:对
答案:A
9.据相律,恒沸混合物的沸点不随外压的改变而改变。 ( )
A:对 B:错
答案:B
10.临界温度是气体加压液化所允许的最高温度。( )
A:错 B:对
答案:B
1.下列叙述中不属于状态函数特征的是( )。
A:状态函数均有加和性 B:系统状态确定后,状态函数的值也确定 C:系统变化时,状态函数的改变值仅由系统的始、终态决定而与过程无关
答案:A
2.在使用物质的量时,必须指明物质的基本单元,以下不正确的是( )。
A:1 mol (
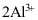 )
B:1 mol (
)
B:1 mol (答案:C
3.400K、101325Pa下,1mol气体的体积为22.85 dm3,则气体的压缩因子=( )。
A:1.2532 B:1 C:0.6962
答案:C
4.下图为某物质的压缩因子图,图中标有三条等温线,则三条线上注明的温度T1、T2、T3,其大小关系是( )。

A:
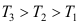 B:
B: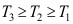 C:
C: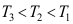
答案:A
5.甲、乙、丙三种物质的临界温度分别为343.05K、373.65K和405.65K,其中最易液化的气体为( )。
A:乙物质 B:丙物质 C:甲物质
答案:B
6.范德华气体分子的微观模型为( )。
A:只具有吸引力的硬球 B:不具有吸引力的硬球 C:只具有吸引力的软球
答案:A
7.在一定温度和压力下求解范德华方程,得到三个摩尔体积的值:0.0523、0.2534和2.9523
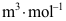 ,其中饱和液体的摩尔体积为( )。
,其中饱和液体的摩尔体积为( )。A:
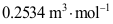 B:
B: C:
C: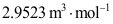
答案:B
8.物质A和B的对比温度相等、对比压力也相等,按对应状态原理,以下结论不一定正确的是( )。
A:它们的对比体积相同 B:它们的压缩因子相同 C:它们的体积相同
答案:C
9.一隔板将一刚性绝热容器分为左右两侧,左室气体的压力大于右室气体的压力。现将隔板抽去,左、右气体的压力达到平衡。若以全部气体作为系统,则( )。
A:W< 0、Q >0、
 =0
B:W=0、Q =0、
=0
B:W=0、Q =0、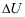 =0
C:W>0、Q < 0、
=0
C:W>0、Q < 0、 =0
=0
答案:B
10.物质的标准摩尔蒸发焓为
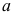 ,标准摩尔熔化焓为
,标准摩尔熔化焓为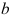 ,标准摩尔升华焓为
,标准摩尔升华焓为 ,三者间的关系为( )。
,三者间的关系为( )。A:
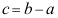 B:
B: C:
C: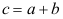
答案:C
1.1 mol 373 K,标准压力下的水,分别经历:(1) 等温、等压可逆蒸发,(2) 真空蒸发,变成373 K,标准压力下的水气。这两种过程的功和热的关系为: ( )
A:W 1= W 2 Q 1= Q 2 B:W 1< W 2 Q 1> Q 2 B.W 1< W 2 Q 1< Q 2 C:W 1> W 2 Q 1< Q 2
答案:B
2.对于封闭体系,在指定始终态间的绝热可逆途径可以有: ( )
A:二条 B:三条以上 C:一条 D:三条
答案:C
3.一可逆热机与另一不可逆热机在其他条件都相同时,燃烧等量的燃料,则可逆热机拖动的列车运行的速度: ( )
A:较慢 B:一样 C:较快 D:不一定
答案:A
4.1mol 的液态水在373K和1.013×105Pa 的条件下蒸发,其内能的变化为38281J,则焓变为 ( )
A:41840J B:38740J C:41382J D:35180J
答案:C
5.在标准压力下,1mol石墨与氧气反应生成1mol二氧化碳的反应热为ΔH,下列哪种说法错误? ( )
A:ΔH =ΔU B:ΔH 是CO2(g)的标准生成热 C:ΔU <ΔH D:ΔH 是石墨的燃烧热
答案:C
6.不可逆过程就是过程发生后,系统不能再复原的过程。( )
A:对 B:错
答案:B
7.根据热力学第一定律,因为能量不能无中生有,所以一个系统若要对外做功,必须从外界吸收热量。( )
A:错 B:对
答案:A
8.在等压下,用机械搅拌某绝热容器中的液体,使液体的温度上升,这时ΔH = Q p= 0 。( )
A:对 B:错
答案:B
9.一氧化碳的标准摩尔生成焓也是同温下石墨标准摩尔燃烧焓。( )
A:对 B:错
答案:B
10.恒温过程的Q一定是零。( )
A:错 B:对
答案:A
1.
理想气体压强、温度和体积之间满足的关系是
A: PV=nR(T-a) B: (P-a)V=nRT C:P(V-a)=nRT D:PV=nRT
答案:D
2.
理想气体是忽略了
A:分子间的相互作用
答案:AB
3.
1 mol单原子分子理想气体,当其经历一循环过程后,作功W= 400 J,则该过程的热量Q为:
A: 0 B:因未指明是可逆过程,无法确定 C:-400 J D:400 J
答案:C
4.
某理想气体从同一始态(p1,V1,T1)出发,分别经恒温可逆压缩和绝热可逆压缩至同一体积V2,若环境所做功的绝对值分别为WT和WA,问WT和WA的关系如何?
A:WT =WA B:WT和WA无确定关系 C:WT <WA D: WT>WA
答案:C
5.
封闭体系从 A 态变为 B 态,可以沿两条等温途径:甲)可逆途径;乙)不可逆途径则下列关系式: ⑴ ΔU可逆> ΔU不可逆 ⑵ W可逆 > W不可逆
⑶ Q可逆 > Q不可逆 ⑷ ( Q可逆 - W可逆) > ( Q不可逆 - W不可逆)
正确的是:
A:(1),(2) B:(3),(4) C:(2),(3) D:(1),(4)
答案:C
6.
下面陈述中,正确的是:
两物体之间只有存在温差,才可传递能量,反过来体系与环境间发生热量传递后, 必然要引起体系温度变化
A:虽然Q和W是过程量,但由于QV =ΔU,Qp=ΔH,而U和H是状态函数,所以QV和Qp是状态函数
B: 两物体之间只有存在温差,才可传递能量,反过来体系与环境间发生热量传递后, 必然要引起体系温度变化 C:热量是由于温度差而传递的能量,它总是倾向于从含热量较多的高温物体流向含热量较少的低温物体 D: 封闭体系与环境之间交换能量的形式非功即热
答案:D
7.
恒容下,一定量的理想气体,当温度升高时内能将
A: 降低 B:增加 C: 不变 D:增加、减少不能确定
答案:A
8.
实际气体的节流膨胀过程中,哪一组的描述是正确的?
A:Q=0,△H<0,△P>0 B:Q=0,△H=0,△P<0 C: Q<0,△H=0,△P<0 D:Q>0,△H=0,△P<0
答案:B
9.
理想气体的焦耳-汤姆孙系数一定等于零。此话对吗
A:对 B:错
答案:A
10.
理想气体向真空绝热膨胀,dU=0,dT=0,而实际气体的节流膨胀过程dH=0,dT≠0。上述两结论对吗?
A:错 B:对
答案:B
1.热力学第一定律 ΔU=Q+W 只适用于( )
A:单纯状态变化
B:封闭系统的任何变化
C:化学变化
D:相变化
答案:B
2.下列哪个封闭体系的内能和焓仅是温度的函数( )
A:理想溶液
B:稀溶液
C:理想气体
D:所有气体
答案:C
3.理想气体向真空膨胀,其体积从V1增大到V2,则体系做功为W=0( )
A:对 B:错
答案:A
4.
1mol理想气体在密闭容器中进行绝热膨胀时,体系的温度下降( )
A:错 B:对
答案:B
5.对于理想气体,不论是恒压过程还是恒容过程,公式ΔH=∫CpdT都适用。 ( )
A:错 B:对
答案:B
1. 理想气体模型的基本特征是( )
A:各种分子间的作用相等,各种分子的体积大小相等 B:分子不断地作无规则运动、它们均匀分布在整个容器中 C:分子间无作用力, 分子本身无体积 D:所有分子都可看作一个质点, 并且它们具有相等的能量
答案:C
2.关于物质临界状态的下列描述中, 不正确的是( )
A:临界温度越低的物质, 其气体越易液化 B:每种气体物质都有一组特定的临界参数 C:在临界状态, 液体和蒸气的密度相同, 液体与气体无区别 D:在以p、V为坐标的等温线上, 临界点对应的压力就是临界压力
答案:A
3. 对于实际气体, 下面的陈述中正确的是( )
A:对于实际气体, 范德华方程应用最广, 并不是因为它比其它状态方程更精确 B:处于相同对比状态的各种气体,不一定有相同的压缩因子 C:不是任何实际气体都能在一定条件下液化 D:临界温度越高的实际气体越不易液化
答案:A
4.理想气体状态方程pV=nRT表明了气体的p、V、T、n、这几个参数之间的定量关系,与气体种类无关。该方程实际上包括了三个气体定律,这三个气体定律是( )
A:波义尔定律、阿伏加德罗定律和分体积定律 B:阿伏加德罗定律、盖-吕萨克定律和波义尔定律 C:波义尔定律、盖-吕萨克定律和分压定律 D:分压定律、分体积定律和波义尔定律
答案:B
5.一定量的某种理想气体,在确定该系统的状态时,只需要说明系统的( )。
A:T, U B:V C:p D:T, p
答案:D
1.下列不属于物理化学主要学习内容的是( )
A:自由基聚合 B:热力学第一定律 C:反应动力学 D:热力学第二定律
答案:A







