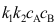第六章测试1. 有关杠杆规则表示正确的有。( )
A:
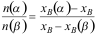 B:
B: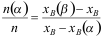 C:
C: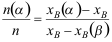 D:
D: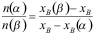
答案:D
2. 将过量的NaHCO3(s)放入一真空密闭容器中,50℃时发生如下分解反应:
2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g)
系统达到平衡后,其组分数C和自由度数F分别是( )。
A:3,2 B:2,0 C:2,1 D:3,1 3. 在某一温度下,由纯A与纯B形成理想液态混合物。已知
 ,当汽液两相平衡时,气相组成
,当汽液两相平衡时,气相组成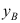 总是( )液相组成
总是( )液相组成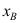 。
。A:>; B:无法判断 C:<; D:=; 4. 通常情况下,对于二组分物系能平衡共存的最多相为( )
A:3 B:4 C:2 D:1 5. 已知Na2CO3(s)和H2O(l)可以生成三种水合物:Na2CO3·H2O(s),Na2CO3·7H2O(s),Na2CO3·10H2O(s)。求一个大气压下,与Na2CO3水溶液和冰平衡共存的水合盐的最大值。( )
A:1 B:3 C:4 D:2 6. 依据相律,纯液体在一定温度下,蒸气压应该是定值。( )
A:错 B:对 7. 恒沸混合物的组成与外压有关,并不是恒定不变的。( )
A:对 B:错 8. 相图中的点都是代表系统状态的点。( )
A:错 B:对 1.298K时,KNO水溶液的浓度由1mol·dm增大到2 mol·dm,其摩尔电导率Λ将( )。
A:增大
B:减小
C:不变
D:不确定
2.298K时,下列两电极反应的标准电极电势为:
Fe+ 3e→ Fe (Fe/Fe)=-0.036V
Fe+ 2e→ Fe (Fe/Fe)=-0.439V
则反应Fe+ e→Fe的(Pt/Fe, Fe)等于( )。
A:-0.184V
B:0.184V
C:0.352V
D:0.770V
3.将反应 H+ 1/2O=HO 设计成可逆电池,下列电池中正确的是( )
A:Pt│H(p)│HO(l)│H(p)│Pt
B:Pt│H(g)│NaOH(aq)‖HCl(aq)│O(g)│Pt
C:Pt│O(g)│OH(aq)‖H(aq)│H(g)│Pt
D:Pt│H(g)│NaOH(aq)│O(g)│Pt
4.对于电池Zn(s)|ZnSO4(aq)||AgNO3(aq)|Ag(s),其中的盐桥可以用饱和KCl溶液。( )
A:错 B:对 5.电池放电时,随电流密度增加阳极电位变更正,阴极电位变更负。( )
A:错 B:对 1.下面的叙述中违背平衡移动原理的是 ( )
A:升高温度平衡向吸热方向移动
B:加入惰性气体平衡向总压力减少的方向移动
C:降低压力平衡向增加分子数的方向移动
D:增加压力平衡向体积缩小的方向移动
2.900℃时氧化铜在密闭的抽空容器中分解,反应为:2CuO(s)= Cu2O(s)+1/2O2(g),测得平衡时氧气的压力为1.672kPa,则其平衡常数 Kθ为:( )
A:0.128
B:7.81
C:0.00825
D:0.0165
3.对于理想气体间的反应,以各种形式表示的平衡常数中,其值与温度和压力皆有关系的是:( )
A:Kc
B:Kx
C:Ka
D:Kp
4.已知445℃时, Ag2O(s)的分解压力为20974kPa,则此时分解反应 Ag2O(s)=2Ag(s)+1/2O2(g)的ΔrGm ( )
A:-31.83 kJ·mol-1
B:14.387kJ·mol-1
C:15.92 kJ·mol-1
D:-15.92 kJ·mol-1
5.某放热反应在T=800K,压力p下进行,达平衡后产物的百分含量是50%,若反应在T=200K,压力p下进行,平衡时产物的百分含量将:( )
A:不变
B:增大
C:不能确定
D:减小
1.对于水平液面,下面哪个物理量为零? ( )
A:正压力
B:表面能
C:表面张力
D:附加压力
2.密闭玻罩中有大小不一的微小萘粒,放置一段时间后,出现的现象是 ( )
A:大粒消失,小粒长大
B:萘粒大小无变化
C:小粒消失,大粒长大
D:变成相同大小萘粒
3.HLB值越大,表面活性剂的亲水性越大。( )
A:对 B:错 4.液体产生过冷、过热、过饱和现象的根本原因是新相种子容易生成( )
A:错 B:对 5.为了提高农药杀虫效果,应选择润湿角(>90°, <90°) < 70° 的溶剂( )
A:错 B:对 1.
有一露于空气中的球形液膜,若其直径为 2×10-3 m,表面张力为 0.7 N·m-1,则该液膜所受的附加压力为:
A: 1.4 kPa B:2.8 kPa C: 5.6 kPa D: 8.4 kPa 2.
半径为 1×10-2 m 的球形肥皂泡的表面张力为 0.025 N·m-1,其附加压力为:
A:10 N·m-2
B:0.25 N·m-2 C: 0.025 N·m-2 D: 2.5 N·m-2 3.
下列说法中不正确的是:
A:生成的新鲜液面都有表面张力 B: 弯曲液面的表面张力的方向指向曲率中心 C:平面液体没有附加压力 D:弯曲液面的附加压力指向曲率中心 4.
在农药中通常都要加入一定量的表面活性物质, 如烷基苯磺酸盐, 其主要目的是
A:提高农药对植物表面的润湿能力 B:增加农药的杀虫药性 C:消除药液的泡沫
D:防止农药挥发 5.
表面活性剂具有增溶作用,对增溶作用说法不正确的是:
A:增溶作用可以使被溶物的化学势大大降低
B:增溶作用与乳化作用不同 (增溶作用可以使被溶物的化学势大大降低
C: 增溶作用是一个可逆的平衡过程 D:增溶作用也就是溶解作用 6.
固体能被液体润时,接触角θ()90度。
A:不确定
B:小于
C:等于
D: 大于 7.
液体在玻璃上完全不润湿时,接触角θ=0度,
A:错 B:对 8.
汞在玻璃上完全不润湿
A:错 B:对 9.
在稀的砷酸溶液中,通入 H2S 以制备硫化砷溶胶 (As2S3),该溶胶的稳定剂是
H2S,则其胶团结构式是:
A:[(As2S3)m·nHS-,(x)H+]x-·xH+
B:[(As2S3)m·nH+,(n-x)HS-]x-·xHS- C: [(As2S3)m·nH+,(x)HS-]x-·xHS- D: [(As2S3)m·nHS-,(n-x)H+]x-·xH+ 10.
向 FeCl3(aq) 中加入少量氨水,可制备稳定的氢氧化铁溶胶,此时胶体粒子带
电荷情况为:
A:总是带负电 B:在 pH 较大时带负电
C: 总是带正电 D:在 pH 较大时带正电 1.分子的平动.转动和振动的能级间隔的大小顺序是: ( )
A:平动能 > 振动能 > 转动能 B:振动能 > 平动能 > 转动能 C:振动能 > 转动能 > 平动能 D:转动能 > 平动能 > 振动能 2.NH3分子的平动.转动.振动.自由度分别为: ( )
A:3, 2, 7 B:3, 2, 6 C:3, 3, 6 D:3, 3, 7 3.对于 N 个粒子构成的独立可别粒子体系熵的表达式为: ( )
A:S = kln(qN/N!) + NkT(lnq/T) V,n B:S = Nklnq + NkT2(lnq/T) V,n C:S = Nklnq + NkT(lnq/T)V,n D:S = NkT2(lnq/T) V,n 4.在分子运动的各配分函数中与压力有关的是: ( )
A:振动配分函数 B:电子运动的配分函数 C:平均配分函数 D:转动配分函数 5.关于配分函数,下面哪一点是不正确的: ( )
A:粒子的配分函数是一个粒子所有可能状态的玻耳兹曼因子之和 B:粒子的配分函数只有在独立粒子体系中才有意义 C:只有平动配分函数才与体系的压力有关 D:并不是所有配分函数都无量纲 6.玻耳兹曼熵定理一般不适用于: ( )
A:单个粒子 B:理想气体 C:独立子体系 D:量子气体 7.玻耳兹曼分布 ( )
A:是最概然分布,但不是平衡分布 B:不是最概然分布,也不是平衡分布 C:是平衡分布,但不是最概然分布 D:即是最概然分布,又是平衡分布 8.
对于服从玻耳兹曼分布定律的体系,其分布规律为: ( )
A:视体系的具体条件而定 B:其他选项都不对 C:能量最低的单个量子状态上的粒子数最多 D:第一激发能级上的粒子数最多 9.粒子的配分函数q是: ( )
A:对一个粒子的玻耳兹曼因子取和 B:一个粒子的 C:粒子的简并度和玻耳兹曼因子的乘积取和 D:对一个粒子的所有可能状态的玻耳兹曼因子取和 1.
下面说法不正确的是: ( )
A:弯曲液面的表面张力的方向指向曲率中心 B:弯曲液面的附加压力指向曲率中心 C:平面液面没有附加压力 D:生成的新鲜液面都有表面张力 2.
在农药中通常都要加入一定量的表面活性物质, 如烷基苯磺酸盐, 其主要目的是: ( )
A:消除药液的泡沫 B:提高农药对植物表面的润湿能力 C:增加农药的杀虫药性 D:防止农药挥发 3.
当表面活性物质加入溶剂后,所产生的结果是: ( )
A:dg / da < 0,负吸附 B: dg / da > 0,负吸附 C:dg / da < 0,正吸附 D:dg / da > 0,正吸附 4.
多孔硅胶的强烈吸水性能说明硅胶吸附水后,表面自由能将: ( )
A:变低 B:不变 C:不能比较 D:变高 5.
将一毛细管端插入水中,毛细管中水面上升 5 cm,若将毛细管向下移动,留了3 cm 在水面,试问水在毛细管上端的行为是( )
A:毛细管上端水面呈凸形弯月面 B:毛细管上端水面呈水平面 C:水从毛细管上端溢出 D:毛细管上端水面呈凹形弯月面 6.
如图在毛细管内装入润湿性液体,当在毛细管内左端加热时,则管内液体将: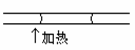 ( )
( )
A:不移动 B:向左移动 C:向右移动 D:因失去平衡而左右来回移动 7.
把细长不渗水的两张白纸互相靠近(距离为 d ),平行地浮在水面上,用玻璃棒轻轻地在两纸中间滴一滴肥皂液,两纸间的距离将 ( )
A:不变 B:减小 C:A、B、C 都有可能 D:增大 8.
有一露于空气中的球形液膜,若其直径为 2×10-3 m ,表面张力为 0.7 N/m,则该液膜所受的附加压力为: ( )
A:
1.4 kPa
B:2.8 kPa
C:5.6 kPa
D:8.4 kPa
9.两液体A和B表面张力gA=gB,密度rA=2rB,一毛细管插入A中液面上升2.0 cm,插入B中液面上升多少?(假定两液体皆完全润湿管壁) ( )
A:5.0 cm B:2.0 cm C:4.0 cm D:1.0 cm 10.
已知某溶质溶于水后,溶液表面张力g 与活度 a 的关系为:g = g0- Aln(1 + ba ),其中 g0为纯水表面张力,A、b 为常数,则此溶液中溶质的表面过剩G 与活度 a 的关系为: ( )
A:G = - Aba / RT(1+ba) B:G = - Aa / RT(1+ba) C: G = Aba / RT(1+ba) D:G = Aa / RT(1+ba) 1.在一定温度下,在水和四氯化碳组成的液相不相溶系统中,向水层中加入1:1的KI和I2,此系统的自由度0。( )
A:错 B:对 2.当克拉佩龙方程用于纯物质两相平衡时,下列说法错误的是( )。
A:平衡压力不随温度变化而变化 B:随着温度升高,平衡压力增大 C:随着温度升高,平衡压力可能增大也可能减小 D:随着温度升高,平衡压力减小 3.一定温度下,在刚性封闭系统中,A、B二组分理想液态混合物达到气液两相平衡,纯B的饱和蒸气压大于纯A的饱和蒸气压,若向系统中加入少量B组分后达到新的平衡,系统内的压力将( )。
A:无法确定 B:增大 C:不变 D:减小 4.
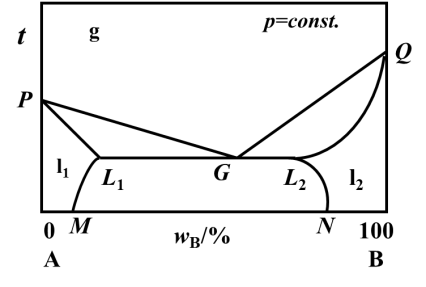 A、B二组分组成的液态部分互溶系统相图中,三相线表示纯A、纯B和气体三相平衡共存。( )
A、B二组分组成的液态部分互溶系统相图中,三相线表示纯A、纯B和气体三相平衡共存。( ) A:对 B:错 5.A和B形成理想液态混合物,在这个气液平衡系统中,液相中A和B的物质的量都是2mol,纯A和纯B的饱和蒸气压分别为90kPa和30kPa,则气相摩尔分数之比yA : yB为( )。
A:6 : 1 B:4 : 1 C:8 : 1 D:3 : 1 6.
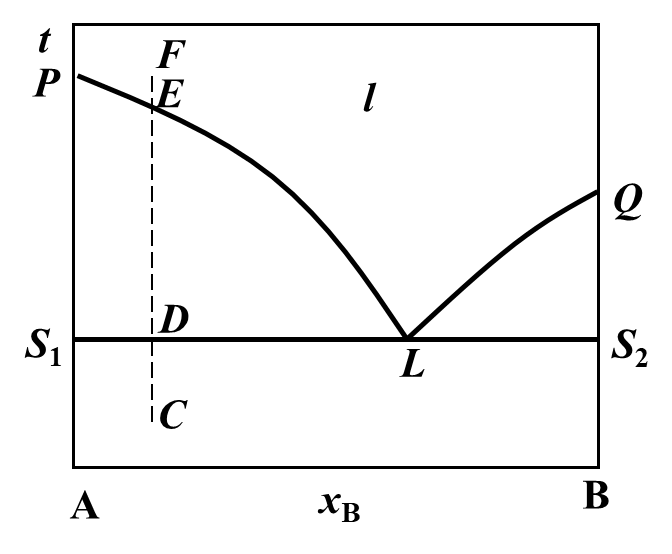 A、B二组分液-固平衡系统如图所示,若系统从C点开始升温,D→E之间的现象是( )。
A、B二组分液-固平衡系统如图所示,若系统从C点开始升温,D→E之间的现象是( )。A:不断析出A(s) B:液相组成沿着曲线LE变化 C:B(s)不断减少 D:A(s)不断减少 7.液态完全互溶的A、B二组分组成的气液平衡系统,在T-x图上有最高点(该点温度比A组分和B组分的沸点都高),则该系统对拉乌尔定律产生( )。
A:没有偏差 B:负偏差 C:正偏差 D:无法确定 8.
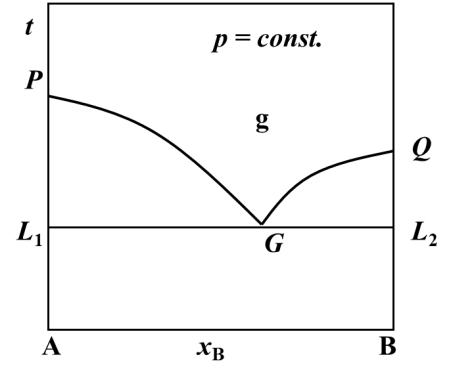 A、B二组分组成的液态完全不互溶系统中,若系统组成与G点组成相同,则系统从高温气态冷却过程中不会出现气液两相平衡共存的阶段。( )
A、B二组分组成的液态完全不互溶系统中,若系统组成与G点组成相同,则系统从高温气态冷却过程中不会出现气液两相平衡共存的阶段。( ) A:错 B:对 9.
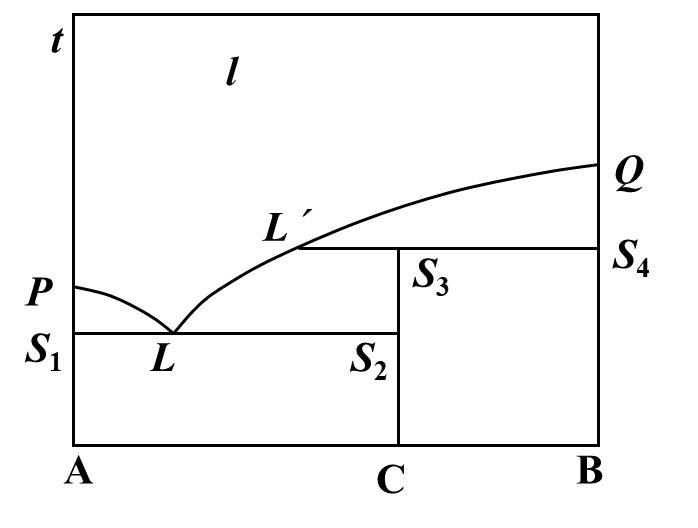 若将二组分相图中的纯C(s)缓慢升温至固体完全消失,加热过程中能够观察到的现象是( )。
若将二组分相图中的纯C(s)缓慢升温至固体完全消失,加热过程中能够观察到的现象是( )。A:B(s)、液相、C(s)三相共存 B:C(s)分解 C:A(s)、液相、C(s)三相共存 D:A(s)出现 10.
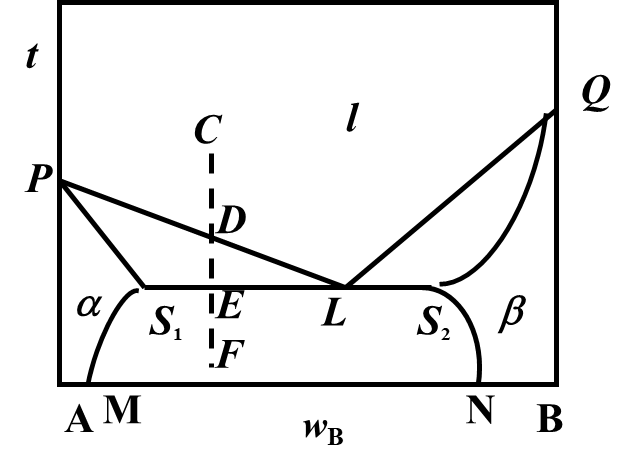 固态部分互溶的二组分凝聚系统如图所示,系统延CF冷却,D→E之间存在的相是( )。
固态部分互溶的二组分凝聚系统如图所示,系统延CF冷却,D→E之间存在的相是( )。 A:A(s)和液相 B:液相和α相 C:A(s)和α相 D:A(s)、α相和液相 1.有两个都是一级的平行反应
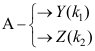 ,下列哪个关系是错误的?( )
,下列哪个关系是错误的?( )A:
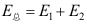 B:
B: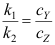 C:
C: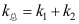 D:
D: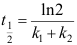 2.某反应的速率常数k=4.62
2.某反应的速率常数k=4.62A:30min B:
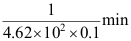 C:
C: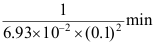 D:15min
3.基元反应的分子数是个微观概念,其值为( )。
D:15min
3.基元反应的分子数是个微观概念,其值为( )。A:可正、可负、可为零 B:只能是1,2,3这三个整数 C:0,1,2,3 D:可以是小于1的数 4.两个H˙与M粒子同时碰撞,发生下列反应:H˙+H˙+M
A:不能确定 B:大于零 C:等于零 D:小于零 5.对于一个一级反应,如其半衰期在0.01S以下即称为快速反应,此时它的速率常数k值在( )。
A:6.932 S-1以下 B:6.932 S-1以上 C:69.32 S-1以上 D:0.06932 S-1以上 6.基元反应
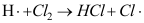 属于( )。
属于( )。A:单分子反应 B:双分子反应 C:三分子反应 D:四分子反应 7.催化剂的作用是( )。
A:缩短反应达到平衡的时间 B:加快正反应速率 C:提高反应物转化率 D:使ΔG>0的反应进行 8.对反应
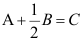 ,有( )。
,有( )。A:
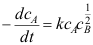 B:反应的级数为1.5
C:反应的分子数为1.5
D:
B:反应的级数为1.5
C:反应的分子数为1.5
D: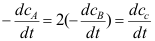 9.某反应
9.某反应A:0.2min B:2min C:0.1min D:1min 10.对于一般服从阿仑尼乌斯方程的化学反应,温度越高反应速度越快,因此升高温度有利于生成更多的产物。( )
A:错 B:对 1.已知Cu的原子量为63.54,用0.5F电量可以从CuSO4溶液中沉淀出多少克Cu?( )
A:16克 B:64克 C:127克 D:32克 2.在298 K时,当 H2SO4溶液的浓度从 0.01 mol·kg-1 增加到 0.1 mol·kg-1时,其电导率k 和摩尔电导率Lm的变化分别为:( )
A:k减小 , Lm减小 B:k增加 , Lm减小 C:k减小 , Lm增加 D:k增加 , Lm增加 3.按物质导电方式的不同而提出的离子型导体,下述对它特点的描述,哪一点是不正确的? ( )
A:其电阻随温度的升高而增大 B:其导电的原因是离子的存在 C:其电阻随温度的升高而减小 D:当电流通过时在电极上有化学反应发生 4.有下面四种电解质溶液,浓度均为0.01 mol·dm-3,现已按它们的摩尔电导率Lm的值,由大到小排了次序。请判定下面正确的是:( )
A:HCl > KOH > KCl > NaCl B:HCl > NaCl > KCl > KOH C:NaCl > KCl > KOH > HCl D:HCl > KOH > NaCl > KCl 5.CaCl2 摩尔电导率与其离子的摩尔电导率的关系是: ( )
A:Λ∞(CaCl2) = λm(Ca2+) + 2λm(Cl-) B:Λ∞(CaCl2) = 2 [λm(Ca2+) +λm(Cl-)] C:Λ∞(CaCl2) = 1/2 λm(Ca2+) + λm(Cl-) D:Λ∞(CaCl2) = λm(Ca2+) + λm(Cl-) 6.电解质溶液的电导率随浓度增大而增大。( )
A:对 B:错 7.离子独立运动定律适用于无限稀电解质溶液。( )
A:对 B:错 8.温度越高,电解质溶液的电阻越大。( )
A:对 B:错 9.稀释强电解质溶液时,其摩尔电导率Λm将增大。( )
A:对 B:错 10.电解质溶液的摩尔电导率可以看作是正、负离子的摩尔电导率之和。( )
A:错 B:对 1.基元反应
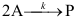 ,其化学反应速率
,其化学反应速率A:
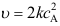 、
、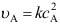 B:
B: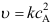 、
、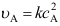 C:
C: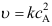 、
、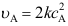 2.零级反应( )基元反应。
2.零级反应( )基元反应。A:肯定是 B:不一定是 C:肯定不是 3.单向进行的化学反应
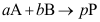 ,如
,如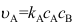 ,则
,则A:
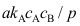 C:
C: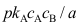 4.基元反应2A→B为双分子反应,此反应为( )反应。
4.基元反应2A→B为双分子反应,此反应为( )反应。A:一级 B:二级 C:零级 5.
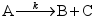 为零级反应,A的半衰期为40 min,则A消耗1/4时所需时间为( )。
为零级反应,A的半衰期为40 min,则A消耗1/4时所需时间为( )。A:20 min B:40 min C:60 min 6.对于反应
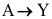 ,测得反应物A的浓度
,测得反应物A的浓度A:零级 B:一级 C:二级 7.丁二烯的液相聚合反应, 实验确定为一级,并测得在323 K时,其速率系数为3.300×10-2 min-1, 当丁二烯的转化率为80%时, 反应时间为( )。
A:28.78 min B:48.78 min C:68.78 min 8.某具有简单级数的反应,k = 0.1 dm3·mol-1·s-1,起始浓度为 0.1 mol·dm-3,当反应速率降至起始速率 1/4 时,所需时间为( )。
A:100 s B:10 s C:300 s 9.一级连串反应
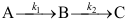 中,如果B是目标产物,为最经济地由原料A生产B,假设工艺上采取的措施包括:① 控制反应时间为最佳时间、② 适当延长反应时间、③ 如原料A很贵,副产物C价值不高,可适当缩短反应时间。则最正确的方案是( )。
中,如果B是目标产物,为最经济地由原料A生产B,假设工艺上采取的措施包括:① 控制反应时间为最佳时间、② 适当延长反应时间、③ 如原料A很贵,副产物C价值不高,可适当缩短反应时间。则最正确的方案是( )。A:①和③ B:②和③ C:①和② 10.正向反应放热的对峙反应,在给定的转化率下,随温度的升高,反应速率( )。
A:先增加后下降 B:一直降低 C:一直增加 11.若平行反应
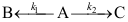 中的两个反应具有相同的反应级数,反应开始时系统中只有反应物A,反应时间为5min 时,测得
中的两个反应具有相同的反应级数,反应开始时系统中只有反应物A,反应时间为5min 时,测得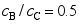 ,则
,则A:3 B:1 C:2 12.以下说法不正确的是( )。
A:温度对化学反应速率的影响主要表现为对反应速率系数的影响 B:升高温度对活化能较高的化学反应有利 C:升高温度对所有反应均有利 13.将
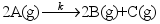 反应的速率系数的对数对温度的倒数作图[即
反应的速率系数的对数对温度的倒数作图[即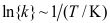 ]可到一条直线,直线的斜率为12.40103,截距为31.36。假定活化能与温度无关,则该反应的活化能等于( )kJmol1。
]可到一条直线,直线的斜率为12.40103,截距为31.36。假定活化能与温度无关,则该反应的活化能等于( )kJmol1。A:103.1 B:83.1 C:93.1 14.一级对峙反应
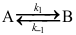 的速率系数k-1和平衡常数K(量纲为一)与温度的关系如下:
的速率系数k-1和平衡常数K(量纲为一)与温度的关系如下: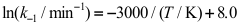
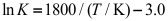 。则速率系数k1与温度的关系式为( )。
。则速率系数k1与温度的关系式为( )。A:
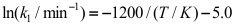 B:
B: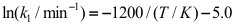 C:
C: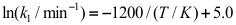 15.复杂反应表观速率系数
15.复杂反应表观速率系数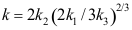 ,则表观活化能
,则表观活化能A:
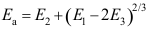 B:
B: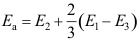 C:
C: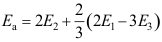 16.某一反应物的平衡转化率为25%,若在催化剂作用下,反应速率增加20倍,则平衡转化率( )。
16.某一反应物的平衡转化率为25%,若在催化剂作用下,反应速率增加20倍,则平衡转化率( )。A:小于25% B:大于25% C:等于25% 17.对于反应
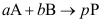 ,若在
,若在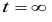 时,反应物消耗殆尽。0, t,
时,反应物消耗殆尽。0, t,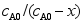 等于( )。
等于( )。A:
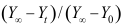 B:
B: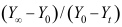 C:
C: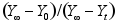 18.反应
18.反应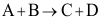 有如下机理:
有如下机理: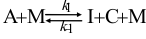 ,
, 。按平衡态处理方法,中间物I的浓度
。按平衡态处理方法,中间物I的浓度A:
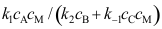 B:
B: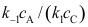 C:
C: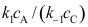 19.反应
19.反应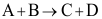 有如下机理:
有如下机理: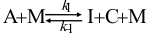 ,
, 。按恒稳态处理方法,中间物I的浓度
。按恒稳态处理方法,中间物I的浓度A:
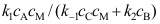 B:
B: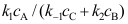 C:
C: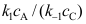 20.
20.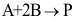 的机理如下:
的机理如下: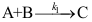 ;
;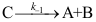 ;
;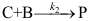 。其中C为高活性中间物,则
。其中C为高活性中间物,则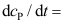 ( )。
( )。A:
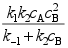 B:
B: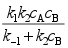 C:
C: