第三章测试1.
抽空密闭容器中加热NH4Cl(s)有NH3(g)和HCl(g)产生,当反应平衡时,其组分数K和自由度f是:( )
A:K=2,f=2 B:K=2,f=1 C:K=1,f=1 D:K=3,f=3
答案:C
2.关于三相点,下面说法正确的是( )
A:三相点一定是气液固的平衡点
B:三相点的自由度为零,也可为 1
C:三相点只有 1 个
D:只有单组分体系才有三相点
3.
在一定温度下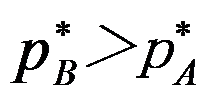 , 由纯液态物质A和B形成理想液态混合物,当气-液两相达到平衡时,气相组成yB总是等于液相组成xB( )
, 由纯液态物质A和B形成理想液态混合物,当气-液两相达到平衡时,气相组成yB总是等于液相组成xB( )
A:对 B:错 4.具有最低恒沸点的A和 B二组分体系,恒沸点组成为C,若原溶液组成为X且在A和C之间,精馏后的馏液组成是C 恒沸物( )
A:错 B:对 5.杠杆规则仅适用于气、液两相平衡体系。 ( )
A:对 B:错 1.
理想溶液具有一定的热力学性质。在下面叙述中哪个是错误的
A:ΔmixA=0 B:ΔmixV=0 C:ΔmixU=0 D:ΔmixH=0 2.
关于理想液体混合物,下面的表述中正确的是:
A:理想液体混合物可以是电解质溶液,也可是非电解质溶液 B:理想液体混合物是指所有分子之间的引力和分子体积都相仿的多组分体系 C:理想液体混合物中任一组分在所有浓度时都遵守拉乌尔定律 D:理想液体混合物一定是无热溶液,但无热溶液不一定是理想溶液 3.
2 mol A物质和3 mol B物质在等温等压下混合形成理想液体混合物,该系统中A和B的偏摩尔体积分别为1.79×10-5 m3×mol-1,2.15×10-5 m3×mol-1 ,则混合物的总体积为:
A: 9.85×10-5 m3 B:8.95×10-5 m3 C:1.003×10-4 m3 D: 9.67×10-5 m3 4.
由A及B二种液体组成理想溶液,A、B的饱和蒸气压分别为p*A、p*B,x为液相组成,y为气相组成,若p*A > p*B( * 表示纯态),则:
A:xA > yA B:xA < yA C:无法确定 D:xA > xB 5.
假设A,B两组分混合可以形成理想液体混合物,说明 A,B 分子之间的作用力很微弱。
A:对 B:错 6.
主要决定于溶解在溶液中粒子的数目,而不决定于这些粒子的性质的特性叫
A:各向同性特性 B: 等电子特性 C:一般特性 D:依数性特征 7.
自然界中,有的高大树种可以长到 100 m以上,能够提供营养及水位到树冠的主要动力是什么?
A:因外界大气压引起的树干内导管的空吸作用 B:树干中微导管的毛细作用 C:树内体液含盐浓度高,渗透压大 D:营养和水分自雨水直接落到树冠上 8.
20摄氏度时,将68.4kg的蔗糖溶于1000g的水中形成稀溶液,则该溶液的渗透压是
A:无法确定 B:4670 Pa C:467000 Pa D:46700 Pa 9.
反渗透已经应用于海水淡化和纯水制备等领域,这种说法对吗?
A:错 B:对 10.
范霍夫公式只适用于稀溶液,这种说法对吗?
A:错 B:对 1.下列四个偏微商中哪个是化学势? ( )
A:(H/nB) S,V, B:(F/nB)T,p, C:(G/nB)S,p, D:(U/nB)S,V, 2.在,两相中均含有A和B两种物质,当达到平衡时,下列哪种情况是正确的? ( )
A: = B: = C: = D: = 3.A,B,C 三种物质组成的溶液,物质 C 的偏摩尔量为: ( )
A:(F/nA B:(/nC C:(H/nC D:(G/nC 4.某物质溶解在互不相溶的两液相 和 中,该物质在 相中以 A 形式存在,在 相中以 A2形式存在,则 和 两相平衡时: ( )
A:c = c B:a = a C:2μ = μ D:μ dn =μ dn 5.下列四个偏微熵中哪个既是偏摩尔量,又是化学势? ( )
A: B: C: D: 6.当温度恒定时,下述说法哪一个正确? ( )
A:增加压力有利于液体变为固体 B:增加压力不利于液体变为固体 C:增加压力与液体变固体无关 D:增加压力不一定有利于液体变为固体 7.关于偏摩尔量,下面的叙述中不正确的是: ( )
A:偏摩尔量的数值可以是正数.负数和零 B:除偏摩尔吉布斯自由能外,其他偏摩尔量都不等于化学势 C:溶液中每一种广度性质都有偏摩尔量,而且都不等于其摩尔量 D:溶液中各组分的偏摩尔量之间符合吉布斯-杜亥姆关系式 8.298 K, p$下,两瓶含萘的苯溶液,第一瓶为2 dm3(溶有0.5 mol萘),第二瓶为1 dm3(溶有0.25 mol萘),若以μ1和μ2分别表示两瓶中萘的化学势,则 ( )
A:μ1= (1/2) μ2 B:μ1=μ2 C:μ1= 2μ2 D:μ1= 10μ2 9.在 400 K,液体A的蒸气压为4×104 Nm-2,液体B的蒸气压为6×104 Nm-2,两者组成理想液体混合物。当气-液平衡时,在溶液中A的摩尔分数为0.6,则在气相中B的摩尔分数应为: ( )
A:0.40 B:0.31 C:0.50 D:0.60 10.已知在373 K时,液体A的饱和蒸气压为66 662 Pa,液体B的饱和蒸气压为1.01 325×105 Pa,设A和B构成理想液体混合物,则当A在溶液中的物质的量分数为0.5 时,气相中A的物质的量分数应为: ( )
A:0.200 B:0.397 C:0.300 D:0.603 11.纯溶剂中加入非挥发性溶质后,沸点升高。该溶液中溶剂的化学势比未加溶质前:( )
A:升高 B:降低 C:不确定 D:相等 12.在400 K时,液体A的蒸气压为4×104 Pa,液体B的蒸气压为6×104 Pa,两者组成理想溶液,平衡时在液相中A的摩尔分数为0.6。则在气相中B的摩尔分数为 ( )
A:0.50 B:0.60 C:0.40 D:0.31 13.氯仿 (1) 和丙酮 (2) 形成非理想液体混合物,在T 时,测得总蒸气压为29 398 Pa,蒸气中丙酮的物质的量分数y2= 0.818 ,而该温度下纯氯仿的饱和蒸气压为29 571 Pa,则在溶液中氯仿的活度a1为: ( )
A:0.813 B:0.181 C:0.823 D:0.500 14.
由渗透压法测得的分子量为: ( )
A:其他都不是 B:数均分子量 C:重均分子量 D:粘均分子量 15.盐碱地的农作物长势不良,甚至枯萎,其主要原因是什么? ( )
A:天气太热 B:肥料不足 C:很少下雨 D:水分从植物向土壤倒流 16.自然界中,有的高大树种可以长到 100 m以上,能够提供营养及水位到树冠的主要动力是什么? ( )
A:因外界大气压引起的树干内导管的空吸作用 B:营养和水分自雨水直接落到树冠上 C:树干中微导管的毛细作用 D:树内体液含盐浓度高,渗透压大 17.主要决定于溶解在溶液中粒子的数目,而不决定于这些粒子的性质的特性叫 ( )
A:一般特性 B:各向同性特性 C:等电子特性 D:依数性特征 18.关于亨利系数,下列说法中正确的是: ( )
A:其值与温度.溶质和溶剂性质及浓度的标度有关 B:其值与温度.浓度和压力有关 C:其值与温度.溶剂性质和浓度有关 D:其值与温度.溶质性质和浓度有关 19.在 298 K 时,A和B两种气体单独在某一溶剂中溶解,遵守亨利定律,亨利常数分别为 kA和 kB,且知 kA> kB,则当 A 和 B 压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为: ( )
A:A 的量与 B 的量无法比较 B:A 的量等于 B 的量 C:A 的量大于 B 的量 D:A 的量小于 B 的量 20.2 mol A物质和3 mol B物质在等温等压下混合形成理想液体混合物,该系统中A和B的偏摩尔体积分别为1.79×10-5 m3mol-1,2.15×10-5 m3mol-1 ,则混合物的总体积为: ( )
A:1.003×10-4 m3 B:9.67×10-5 m3 C:8.95×10-5 m3 D:9.85×10-5 m3 21.对于理想液体混合物: ( )
A:ΔmixV = 0 ΔmixS = 0 B:ΔmixH = 0 ΔmixS = 0 C:ΔmixH = 0 ΔmixG = 0 D:ΔmixV = 0 ΔmixH = 0 22.关于理想液体混合物,下面的表述中不正确的是: ( )
A:理想液体混合物一定是无热溶液,但无热溶液不一定是理想溶液 B:理想液体混合物可以是电解质溶液,也可是非电解质溶液 C:理想液体混合物是指所有分子之间的引力和分子体积都相仿的多组分体系 D:理想液体混合物中任一组分在所有浓度时都遵守拉乌尔定律 1.
下列各量中,属于偏摩尔量的是 ( )
A:
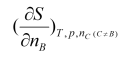 B:
B: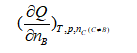 C:
C: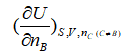 D:
D: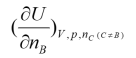 2.
2.下列偏微分中,不是化学势表示式的是( )
A:
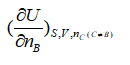 B:
B: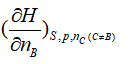 C:
C: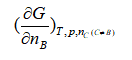 D:
D: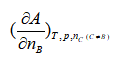 3.
3.在一定的温度和大气压力下,纯溶剂A的饱和蒸气压、化学势和凝固点分别为pA*、mA*、Tf*。加入少量非挥发性溶质后形成理想的稀溶液,A的蒸气压、化学势和凝固点分别为pA、mA、Tf,两者的关系为( )
A:
pA* < pA, mA* < mA, Tf* < Tf
B:pA* < pA, mA* < mA, Tf* > Tf C:pA* > pA, mA* > mA, Tf* > Tf D:pA* > pA, mA* < mA, Tf* < Tf 4.某溶液由2 mol A和1.5 mol B混合而成,总体积为 0.42 dm3。该溶液中已知A的偏摩尔体积VA=0.03 dm3· mol-1 ,则组分B的偏摩尔体积VB为( )
A:0.24 dm3· mol-1 B:0.30 dm3· mol-1 C:0.28 dm3· mol-1 D:
0.20 dm3· mol-1
5.在298K和标准压力下,有2.0 dm3 I2的苯溶液,这时的化学势和Gibbs自由能分别为 m1 和 G1。现取出1.0 dm3,则I2的化学势和Gibbs自由能分别为 m2 和 G2。下面正确的是( )
A:m1 =m2,G1= 2G2 B:
m1 =m2,G1= G2
C:m1 = 2m2,G1= 2G2 D:m1 = 2m2,G1= G2 6.两只烧杯各有1kg水,向A杯中加入0.01 mol蔗糖,向B杯中加入0.01 mol NaCl,两只烧杯按同样速度冷却降温,则有:( )
A:B杯先结冰 B:A杯先结冰 C:无法确定 D:两杯同时结冰 7.
温度273 K,压力为1×106Pa下液态水和固态水的化学势 m(l) 和之间 m(s) 的关系为( )
A:m(l) <m(s) B:m(l) > m(s) C:无确定关系 D:m(l) = m(s) 8.
已知373 K时,液体A的饱和蒸气压为133.24 kPa,液体B的饱和蒸气压为66.62 kPa。设A和B形成理想液态混合物,当A在溶液中的摩尔分数为0.5时,在气相中A的摩尔分数为( )
A:1 B:1/2 C:2/3 D:1/3 9.
含有非挥发性溶质B的水溶液, 在101325 Pa 下,270.15 K时开始析出冰,已知水的kf =1.86 K·kg·mol-1,kb= 0.52 K·kg·mol-1,该溶液的正常沸点是 ( )
A:
372.31 K
B:376.99 K
C:373.99 K
D:370.84 K
10.设373 K和100 kPa时,H2O(g)的化学势为m1,373 K和50 kPa时,H2O(g)的化学势为m2。如果两者有如下四个关系式(1)m1$ = m2$ ; (2)m2 - m1 = RTln2 ; (3)m2 - m1 = - RTln2 ; (4)m2 = m1 – RTln0.5
则这些关系中正确的是( )
A:(2), (4) B:(1), (2) C:(3), (4) D:(1), (3) 1.浓度为1.0mol/dm3的强电解质溶液,它的摩尔电导率数值近似于 ( )。
A:是电导率的102倍 B:与电导率相等 C:是电导率的103倍 D:是电导率的10-3倍 2.1-1型电解质溶液的摩尔电导率可以看作是正负离子的摩尔电导率之和,这一规律只适用于( )。
A:强电解质的稀溶液 B:无限稀电解质溶液 C:摩尔浓度为1的溶液 D:强电解质 3.在25℃无限稀的水溶液中,离子摩尔电导率最大的是( )。
A:
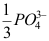 B:
B: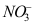 D:
D: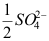 4.0.3 mol·kg-1Na3PO4水溶液的离子强度(mol·kg-1)是 ( )。
4.0.3 mol·kg-1Na3PO4水溶液的离子强度(mol·kg-1)是 ( )。A:0.3 B:0.9 C:1.2 D:1.8 5.用同一电导池测得浓度为0.01mol.dm-3的A溶液和浓度为0.1mol.dm-3的B溶液的电阻分别为1000Ω和500Ω,则它们的摩尔电导率之比Λm(A)/ Λm(B)等于( )。
A:1:20 B:5:1 C:1:5 D:20:1 6.在25℃无限稀的水溶液中,离子摩尔电导率最大的是( )。
A:H+ B:Mg2+ C:La3+ D:NH4+ 7.离子独立运动定律只适用于无限稀的强电解质溶液。 ( )
A:错 B:对 8.用Λm 对
A:对 B:错 9.AlCl3水溶液的质量摩尔浓度若为b,则其离子强度I等于6b。 ( )
A:对 B:错 10.对于一切强电解质溶液-lng ± = A|z+ z-|I1/2 均适用。 ( )
A:对 B:错 1. 根据偏摩尔量的定义,下列正确的是( )。
A:
 B:
B: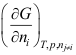 C:
C: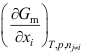 2. 由
2. 由 组成的二元混合物,当
组成的二元混合物,当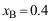 时,混合物的摩尔体积以及
时,混合物的摩尔体积以及 和
和 ,则B的偏摩尔体积=( )
,则B的偏摩尔体积=( )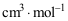 。
。A:50.0 B:40.0 C:31.0 3. 如性质X 随T、p 变化很小,可以忽略,或者温度压力不变时,吉布斯-杜亥姆方程不正确的表达式为( )。
A:
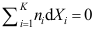 B:
B: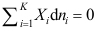 C:
C: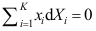 4.273 K、200 kPa时,H2O (l)的化学势为
4.273 K、200 kPa时,H2O (l)的化学势为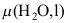 ,H2O (s)的化学势为
,H2O (s)的化学势为 ,两者的大小关系为( )。
,两者的大小关系为( )。A:
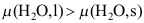 B:
B: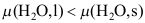 C:
C: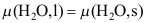 5.如反应
5.如反应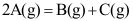 在某时刻下
在某时刻下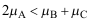 ,此时反应( )。
,此时反应( )。A:正向进行 B:逆向进行 C:已达到平衡 6.在
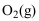 的气体混合物中加入某种固体催化剂,能生成数种气态氮氧化物,当化学反应达到平衡时系统的自由度
的气体混合物中加入某种固体催化剂,能生成数种气态氮氧化物,当化学反应达到平衡时系统的自由度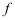 =( )。
=( )。A:1 B:3 C:2 7.T=300K、p=0.2MPa的纯理想气体的化学势与其标准态化学势之差=( )
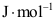 。
。A:1629.95 B:1728.95 C:1529.95 8.相同温度下,组分A和B的饱和蒸气压分别为
 和
和 ,它们形成理想溶液,若
,它们形成理想溶液,若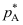 =0.5
=0.5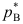
且
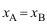 ,则
,则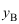 的关系为( )。
的关系为( )。A:
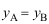 B:
B: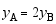 C:
C: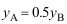 9.理想溶液中组分
9.理想溶液中组分 的化学势表示式为( )。
的化学势表示式为( )。A:
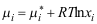 B:
B: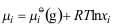 C:
C: 10.对于活度、活度因子以及化学势的表述,正确的是( )。
10.对于活度、活度因子以及化学势的表述,正确的是( )。A:活度和活度因子不随参考状态选择的不同而变化,但化学势变化 B:活度、活度因子以及化学势均随参考状态选择的不同而变化 C:活度和活度因子随参考状态选择的不同而变化,但化学势不变化 1.在如下的偏微分公式中,是偏摩尔量的表示为:( )
A:
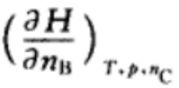 B:
B: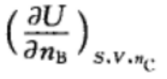 C:
C: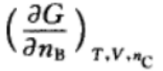 D:
D: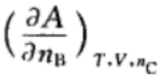 2.在如下的偏微分公式中,是化学势的表示为: ( )
2.在如下的偏微分公式中,是化学势的表示为: ( )A:
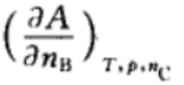 B:
B: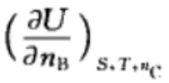 C:
C: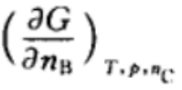 D:
D: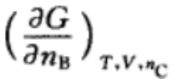 3.对理想溶液中的某组分 A,混合前后下式中正确的是 ( )
3.对理想溶液中的某组分 A,混合前后下式中正确的是 ( )A:VB=Vm,B* B:SB=Sm,B* C:GB=Gm,B* D:AB=Am,B* 4.当溶液中溶质浓度采用不同浓度表示时,下列说法正确的是 ( )
A:溶质的活度相同 B:溶质的标准化学势相同 C:溶质的活度系数相同 D:溶质的化学势相同 5.气体的标准状态是标准压力( 100 kPa)所处的真 实状态。( )
A:错 B:对 6.二组分理想液态混合物的总蒸气压,一定大于任一组分的蒸气分压。 ( )
A:错 B:对 7.相对活度 a=1的状态就是标准态。( )
A:错 B:对 8.亨利定律表达式中的压力pB是指溶液面上的混合气体总压 ( )
A:对 B:错 1. 关于热力学第二定律下列哪种说法是错误的( )。
A:不可能从单一热源吸热做功而无其它变化 B:第二类永动机是造不成的 C:热不可能全部转化为功 D:热不能自动从低温流向高温 2.一卡诺热机在两个不同温度之间的热源之间运转, 当工作物质为气体时, 热机效率为42%, 若改用液体工作物质, 则其效率应当( )。
A:增加 B:无法确定 C:减少 D:不变 3.关于熵的说法正确的是( )。
A:不可逆过程熵将增加 B:可逆过程熵变为零 C:每单位温度的改变所交换的热为熵 D:熵与系统的微观状态数有关 4.在绝热条件下,迅速推动活塞压缩气筒内空气,此过程的熵变( )。
A:无法确定 B:小于零 C:大于零 D:等于零 5.1mol Ag(s)在等容下由273.2K加热到303.2K。已知在该温度区间内Ag(s)的Cv,m=24.48J·K-1·mol-1则其熵变为: ( ) 。
A:2.531 J·K-1 B:5.622 J·K-1 C:25.31 J·K-1 D:56.22 J·K-1 6.关于亥姆霍兹函数A, 下面的说法中不正确的是( )
A:A的值与物质的量成正比 B:虽然A具有能量的量纲, 但它不是能量 C:A是守恒的参量 D:A的绝对值不能确定 7.关于热力学基本方程dU=TdS-pdV, 下面的说法中准确的是( )
A:TdS是过程热 B:TdS是可逆热 C:在可逆过程中, pdV等于体积功, TdS即为过程热 D:pdV是体积功 8.某气体的状态方程为 p[(V/n)-b]=RT ,式中b为常数,n为物质的量。若该气体经一等温过程,压力自p1变至p2,则下列状态函数的变化,何者为零? ( )
A:ΔH B:ΔU C:ΔG D:ΔS 9.理想气体在自由膨胀过程中, 其值都不为零的一组热力学函数变化是( )
A:ΔS、ΔA、ΔV、ΔG B:ΔU、ΔH、ΔS、ΔV C:ΔU、ΔA、ΔH、ΔV D:ΔT、ΔG、ΔS、ΔV 10.关于克劳修斯-克拉佩龙方程下列说法错误的是( )
A:该方程假定气体的体积远大于液体或固体的体积 B:该方程假定与固相或液相平衡的气体为理想气体 C:该方程既适用于液-气平衡又适用于固-气平衡 D:该方程仅适用于液-气平衡 1.热力学温标的基础的是( )
A:
 极限时气体的性质
B:热机在不可逆运转的极限性质
C:热机在可逆运转的极限性质
D:理想溶液性质
2.在一绝热恒温箱中,将NO(g)和O2(g)混合,假定气体都是理想的,达到平衡后肯定都不为零的量是( )。
极限时气体的性质
B:热机在不可逆运转的极限性质
C:热机在可逆运转的极限性质
D:理想溶液性质
2.在一绝热恒温箱中,将NO(g)和O2(g)混合,假定气体都是理想的,达到平衡后肯定都不为零的量是( )。A:∆S、∆U、W B:Q、W、∆U C:∆H、∆S、∆G D:Q、∆U、∆H 3.下列说法正确的是( )。
A:孤立体系中发生的任意过程总是向熵增加的方向进行 B:体系在可逆过程中的热温商的加和值是体系的熵变 C:不可逆过程的热温商之和小于熵变 D:体系发生某一变化时的熵变等于该过程的热温商 4.对于绝热体系,可以用∆S≥0判断过程的方向和限度。( )
A:对 B:错 5.可逆热机的效率最高,在其它条件相同的情况下,由可逆热机牵引火车,其速度将最慢。( )
A:对 B:错 1.当溶质溶于溶剂中形成浓度一定的溶液时,若采用不同的组成表示法,则下列说法正确的是( )。
A:溶质的各标准态化学势数据相同
B:溶质的浓度数据相同
C:溶质的化学势数据相同
D:溶质的活度数据相同
2.混合理想气体中组分B的标准态与混合非理想气体中组分B的标准态( )。
A:不同
B:不一定相同
C:相同
D:无关系
3.100g水中含4.5g某纯非电解质溶液于-0.465℃时结冰,水的=1.86,该溶质的分子量最接近的是( )。
A:180
B:135
C:90;
D:172.4
4.
在稀溶液的凝固点降低公式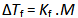 中,
中,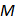 所代表的是溶液中( )。
所代表的是溶液中( )。
A:溶剂的摩尔分数
B:溶质的摩尔分数
C:溶质的质量摩尔浓度
D:溶质的体积摩尔浓度
5.将一束白光照射溶胶,其中散色光强度大的是( )。
A:各色光都一样
B:不能确定
C:红黄色光
D:蓝紫色光
1.关于热力学第二定律,下列说法不正确的是 ( )
A:把热从低温物体传到高温物体,不引起其它变化是不可能的
B:第二类永动机是不可能制造出来的
C:功可以全部转化为热,但热一定不能全部转化为功
D:一切实际过程都是热力学不可逆过程
2.体系从状态A变化到状态B,有两条途径:I为可逆途径,II为不可逆途径。以下关系中不正确的是 ( )
A:
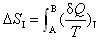
B:
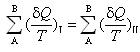
C:
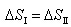
D:
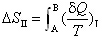
3.已知金刚石和石墨的SmӨ(298K),分别为0.244 J•K-1•mol-1和5.696 J•K-1•mol-1,Vm分别为3.414 cm3•mol-1和5.310 cm3•mol-1,欲增加石墨转化为金刚石的趋势,则应 ( )
A:升高温度,增大压力
B:降低温度,降低压力
C:升高温度,降低压力
D:降低温度,增大压力
4.氮气进行绝热可逆膨胀( )
A:ΔA=0
B:ΔS=0
C:ΔG=0
D:ΔU=0
5.氢气和氧气在绝热钢瓶中生成水( )
A:ΔH=0
B:ΔU=0
C:ΔS=0
D:ΔG=0
1.一空调和冰箱把热从低温热源吸出放给高温热源,这不违反热力学第二定律。( )
A:对 B:错 2.某系统从始态出发,经一个绝热不可逆过程到达终态,熵变可以通过设计绝热可逆过程来求算。( )
A:错 B:对 3.由于系统经循环过程回到始态,ΔG等于零,所以循环过程是可逆过程。( )
A:对 B:错 4.对于某化学反应,其ΔH大于零,ΔS大于零,在低温下不能自动进行,如升高温度,此反应有可能自动进行。( )
A:对 B:错 5.系统达平衡时,熵值最大,吉布斯自由能最小。( )
A:错 B:对 6.理想气体在恒温条件下反抗恒定外压膨胀,变化过程中系统的熵变ΔS1与环境的熵变ΔS2应分别为( )。
A:ΔS1>0,ΔS2=0 B:ΔS1>0,ΔS2<0 C:ΔS1<0,ΔS2>0 D:ΔS1<0,ΔS2=0 7.在大气压力和273.15K下水凝结为冰,下列热力学变量中为零的是( )
A:ΔG B:ΔH C:ΔS D:ΔU 8.H2(g)和O2(g)在绝热钢瓶中化合,生成水的过程( )。
A:ΔU=0 B:ΔS=0 C:ΔH=0 D:ΔG=0 9.碘I2 (s)在指定温度的饱和蒸气压下升华为碘蒸气I2 (g),此过程的( )
A:ΔA<0 B:ΔS<0 C:ΔG<0 D:ΔH<0 10.某化学反应若在300K,100kPa下在试管中进行,放热6×104J,若在相同条件下通过可逆电池进行反应,则吸热6×103J,该化学反应的熵变为( )
A:20J﹒K-1 B:-200J﹒K-1 C:-20J﹒K-1 D:200J﹒K-1







