第八章测试1.
决定波函数的形状,并在多电子原子中与主量子数一起决定电子能量的量子数是( )
A:
n
B:l
l和m
D:m
答案:B
2.下列四个量子数(依次为n,l,m,ms)不合理的一组是:
A:4、0、0、+1/2 B:2、0、1、-1/2 C:4、3、1、-1/2 D:3、1、0、+ 1/2 3.
波函数是原子轨道的同义语,一定的波函数表示一种电子的运动状态。
A:对 B:错 4.对于n=4的电子层,可以容纳的轨道数和电子数分别是16和32。
A:错 B:对 5.
f亚层有几个等价的原子轨道
A:
5个
B:7个 C:9个 1.任何AgCl溶液中,[c(Ag+)/cΘ]和[c(Cl-)/cΘ]的乘积都等于K spΘ ( AgCl )。( )A:错 B:对 2.当溶液中同时存在几种离子时,离子积首先达到溶度积的难溶电解质先生成沉淀,离子积后达到溶度积的则后生成沉淀。 ( )
A:对 B:错 3.CaF2的饱和溶液浓度为2×10-4 mol·L-1,它的溶度积常数是:( )
A:4×10-4 B:3.2×10-11 C:8×10-12 D:8×10-10
4.某溶液中Zn2+和Mn2+的浓度都为0.10 mol⋅L−1。向溶液中通入H2S气体,使溶液中的H2S始终处于饱和状态,则分离两离子的pH范围是( )(已知K spΘ (ZnS)=1.6´10-24,K spΘ (MnS)=2.5´10-13,pKa1Θ(H2S)= 6.97,pKa2Θ(H2S)=12.90)
A:1.70~4.62 B:1.70~5.62 C:2.70~5.62 D:2.70~4.62
5.已知K spΘ(CaCO3)=4.96×10-9,K spΘ(CaSO4)=7.10×10-5,反应CaSO4+CO32-==CaCO3+SO42-的平衡常数是( )
A:1.43×10-4 B:3.52×10-13
C:1.43×104 D:3.52×1015 6.过量AgCl溶解在下列各种物质中,问哪种溶液中C(Ag+)最小 ( )
A:100 mL水 B:1000 mL 0.5 mol·L-1KNO3溶液
C:1000 mL水
D:100 mL 0.2 mol·L-1KCl溶液 1.在直接碘量法中,为了增大单质碘的溶解度,通常采取的措施是( )。
A:增加酸性 B:加入有剂溶剂 C:加热 D:加入过量的KI 2.在选择氧化还原指示剂时,指示剂变色的( )应落在滴定的突跃围,至少也要与突跃围有足够的重合。
A:标准电极电势 B:电势围 C:电极电势 D:电势 3.直接碘量法中所用的指示剂是淀粉溶液。只有( )淀粉与碘形成纯蓝色复合物,所以配制时必须使用这种淀粉。
A:直链 B:食用 C:侧链 D:药用 4.用
 进行滴定时,当溶液中的粉红色在( )不退,就可认为已达到滴定终点
进行滴定时,当溶液中的粉红色在( )不退,就可认为已达到滴定终点A:10 s B:2 min C:1 min D:0.5 min 5.氧化还原滴定曲线中滴定终点偏向滴定突跃的哪一侧,主要取决于( )
A:氧化剂、还原剂各自电子转移数的多少 B:被滴定物质的浓度 C:滴定剂的浓度 D:滴定剂氧化性的强弱 6.在酸性介质中,用
 溶液滴定草酸时,滴定速度( )
溶液滴定草酸时,滴定速度( )A:应开始快,然后慢 B:应始终保持缓慢进行 C:应开始慢,逐渐加快,最后慢 D:像酸碱滴定那样快速 7.间接碘量法一般是在中性或弱酸性溶液中进行,这是因为( )
A:
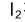 在酸性条件下溶解度小
B:
在酸性条件下溶解度小
B: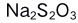 在酸性溶液中容易分解
C:淀粉指示剂在酸性条件下不灵敏
D:
在酸性溶液中容易分解
C:淀粉指示剂在酸性条件下不灵敏
D: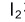 在酸性条件下易挥发
8.标准氢电极的电势为零,是实际测定的结果。( )
在酸性条件下易挥发
8.标准氢电极的电势为零,是实际测定的结果。( )A:对 B:错 9.原电池工作一段时间后,其电动势将发生变化。( )
A:对 B:错 10.铜矿石测铜时I-既是还原剂又是沉淀剂。( )
A:错 B:对 1.氟化镧晶体膜离子选择性电极膜电位的产生是由于( )。
A:氟离子在晶体膜表面还原而传递电子 B:氟离子在晶体膜表面氧化而传递电子 C:氟离子穿透晶体膜使膜内外氟离子产生浓度差形成双电层结构 D:氟离子进入晶体膜表明的晶格缺陷形成双电层结构 2.玻璃电极使用前浸泡的目的是( )。
A:校正电极 B:活化电极 C:清洗电极 D:检查电极性能 3.用氟离子选择性电极测定溶液中氟离子的含量,主要干扰离子是( )。
A:Na+ B:OH- C:La+ D:Ca2+ 4.离子选择性电极的结构中必不可少的部分是( )。
A:孔塞 B:电极杆 C:对特定离子呈能斯特响应的敏感膜 D:内参比电极 5.下列影响电池电动势测量准确度的因素中,最主要的是( )。
A:液接电位的变化 B:酸度计的精度 C:溶液中的共存离子 D:指示电极的性能 6.
我们在测定溶液pH时,需要标准pH缓冲溶液来进行校正测定,其主要的目的是( )。
A:消除温度的影响 B:扣除待测电池电动势与试液pH关系式中的K C:提高测定的灵敏度 D:消除干扰离子的影响 7.
25°C时,离子活度改变10倍,其电位值变化( )。
A:(59.1/n)V B:59.1mV C:(0.0591/nF)V D:0.0591V 8.
在用钠离子玻璃电极来测定钠离子时,可以采用1mol/L氨水和1mol/L氯化钠作总离子强度调节的缓冲液,其主要的作用是( )。
A:提高灵敏度 B:消除液接电位影响 C:控制溶液pH值 D:调节温度 9.
下列对离子选择性电极的选择系数Kij的描述正确的是( )。
A:值越小表明电极选择性越高 B:值越大表明电极选择性越高 C:该值不直接用来衡量电极选择性 D:其它三项答案均不对 10.pH玻璃电极膜电位的产生是由于( )。
A:玻璃膜上的氢离子得到电子 B:玻璃膜上的钠离子得到电子 C:玻璃膜上有电子流动 D:玻璃膜水化层中的氢离子与溶液中的氢离子发生交换作用 1.所谓可见光区,所指的波长范围是( )
A:400~750nm B:100~200nm
C:200~400nm D:750~1000nm 2.在符合朗伯-比尔定律的范围内,溶液的浓度、最大吸收波长、吸光度三者的关系是( )
A:减小、不变、减小 B:增加、增加、增加 C:减小、增加、减小 D:增加、不变、减小
3.某物质摩尔吸光系数很大,则表明( )
A:该物质浓度很大 B:光通过该物质溶液的光程长
C:测定该物质的精密度很高 D:该物质对某波长光的吸光能力很强 4.符合朗伯-比尔定律的有色溶液,当浓度为c时,透光率为T,当浓度增大一倍时,透光率的对数为( )
A:2T B:T / 2 C:½lgT D:2lgT
5.下图为x, y两物质的吸收曲线。今欲在x存在下测定物质y,应选择的光波长为 ( )
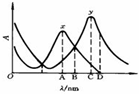
A:A
B:B
C:D
D:C
6.分光光度计的组成部件包括( )
A:检测器
B:光源
C:单色器
D:吸收池
7.对于符合朗伯-比尔定律的有色物质,下列说法错误的是( )
A:浓度增加,摩尔吸光系数变大
B:浓度增加,吸光度A 变大
C:浓度增加,透光率变大
D:浓度增加,最大吸收波长λmax 增大
8.对朗伯比尔定律偏离的原因有 ( )
A:化学反应引起的偏离
B:非单色光引起的偏离
C:吸光度读数误差引起的偏离
D:介质不均匀引起的偏离
9.下列装置中,有助于从复合光中分出所需波长的光的是( )
A:光栅
B:棱镜 C:光电管 D:单色器 10.在吸光光度法定量分析时,为减小测量误差,使透光度的读数处于15% -65%之间,可通过以下哪些方式实现( )
A:改变比色皿的厚度
B:改变待测溶液的浓度
C:改变参比溶液
D:改变测定波长
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!