第二章测试1.已知置信度为90%,n = 6 时,t = 2.015,在一组平行测定中, 所得测定结果如下: 8.44, 8.32, 8.45, 8.52, 8.69, 8.38,下列内容正确的是
A:相对平均偏差为0.11% B:置信度为90%时平均值的置信区间8.47±0.11 C:标准偏差为0.13
答案:BC
2.
已知n = 6 时,Q0.90 = 0. 56。在一组平行测定中,所得测定结果如下: 10.56,10.44,10.57,10.64,10.81,10.50,则
A:
所有数据都是可靠值
B:10.44是可疑值
C:10.81是可疑值
3.系统误差具有重现性,是可测误差A:对 B:错 4.
带有偶然误差的测量数据,不能参加平均值的计算
A:错 B:对 5.
滴定分析中,指示剂确定的滴定终点与化学计量点不一致,由此产生的误差属于试剂误差。
A:错 B:对 6.系统误差主要影响分析测定中的准确度
A:错 B:对 7.pM=-lg[Mn+]=3.00,金属离子浓度[Mn+]有效数字位数为3位
A:错 B:对 8.对于同一组测定数据,置信度越小,置信区间越小。
A:对 B:错 9.用分析天平采用减量法称量试样,要使称量误差不大于0.1%,至少要称取试样
A:2.0g B:0.2g C:0.1g D:1.0g 10.已知 pH=5.25,则[ H+ ]=5.62×10-6mol•L-1 。
A:错 B:对 11.按有效数字运算规则:(2.7+5.9)÷lg2.56的结果有效数字位数是
A:2位 B:4位 C:3位 12.按照“四舍六入五成双”的修约规则,把0.411650修约成四位有效数字,应为0.4116
A:错 B:对 13.测定一试样中Si的百分含量如下: 20.60%, 20.61%, 20.63%, 20.65%, 20.66%,则其相对平均偏差为(结果保留一位有效数字)。
A:0.2% B:0.1% C:1% D:0.5% 14.可用下列哪种方法减小分析测定中的偶然误差
A:空白实验 B:改进测量方法 C:增加测定次数 D:对照实验 15.按有效数字运算规则:(43.5–35.0)×0.126-0.071的结果是
A:1.000 B:1.00 C:1 D:1.0 16.
下列哪种情况造成的误差属于系统误差( )
A:试剂中含有少量被测组分 B:滴定管体积读数时最后一位估读不准 C: 仪器未校准
1.稀溶液的依数性中起决定性的性质是溶液的蒸气压下降。( )
A:对 B:错 2.质量相同的N2和O2,在同温同压下,它们的体积比为7:8。( )
A:错 B:对 3.理想气体状态方程用于真实气体的条件是( )
A:高温、高压
B:低温、低压
C:高温、低压
D:低温、高压
4.由过量KBr溶液与AgNO3溶液混合得到的溶胶,其( )
A:溶胶是负溶胶
B:反离子是NO3-
C:电位离子是Ag+
D:扩散层带负电
5.比较① 0.1 mol·L-1 Na2SO4溶液;② 0.1 mol·L-1 CH3COOH溶液;③ 0.1 mol·L-1 C6H12O6溶液
④ 0.1 mol·L-1 NaCl溶液。各水溶液的渗透压从大到小的顺序为:( )
A:①﹥③﹥④﹥②
B:④﹥③﹥①﹥②
C:①﹥④﹥②﹥③
D:①﹥②﹥③﹥④
6.68%HNO3(相对分子质量为63,密度ρ为1.40g.ml-1)水溶液,质量摩尔浓度为( ) 。
A:33.72 mol/kg
B:38.72 mol/kg
C:38.72
D:33.72
1. 真实气体与理想气体的行为较接近的条件是( )。
A:高温和高压 B:高压和低温 C:低压和高温 D:低温和低压 2. KBr和
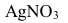 在一定条件下可生成AgBr溶胶,如胶团结构为
在一定条件下可生成AgBr溶胶,如胶团结构为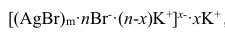 ,反应中过量的溶液是( )。
,反应中过量的溶液是( )。A:
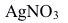 B:都过量
C:KBr
D:都不过量
3.用来描述气体状态的四个物理量分别是( )。
B:都过量
C:KBr
D:都不过量
3.用来描述气体状态的四个物理量分别是( )。A:n, V, p, T B:n, R, p, V C:n, V, R, T D:n, R, T, p。 4.糖水的凝固点为( )。
A:低于0℃ B:无法判断 C:0℃ D:高于0℃ 5. 浓度均为0.1 mol/Kg的蔗糖、HAc,NaCl和
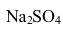 水溶液,其中凝固点最高的是( )。
水溶液,其中凝固点最高的是( )。A:NaCl B:
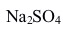 C:HAc
D:蔗糖
6. 对
C:HAc
D:蔗糖
6. 对 正溶胶的凝结能力最大的是( )。
正溶胶的凝结能力最大的是( )。A:NaCl B:
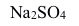 C:
C: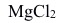 D:
D: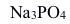 7. 外加直流电场于胶体溶液时,向某一电极方向运动的只是( )。
7. 外加直流电场于胶体溶液时,向某一电极方向运动的只是( )。A:胶核 B:紧密层 C:胶团 D:胶粒 8.稀溶液的依数性主要指溶液的( )。
A:蒸汽压下降 B:沸点升高 C:凝固点下降 D:渗透压 9. 液体的蒸汽压随温度的升高而升高。( )
A:对 B:错 10. 玻璃属于晶态物质。( )
A:对 B:错 11.溶胶粒子产生丁铎尔效应主要是由于胶体离子对光发生了散射。( )
A:错 B:对 1.
以下的说法中,符合洪特规则的是 ( )。
A:原子处于稳定的基态时,其电子尽先占据最低的能级 B:在同一电子亚层上各轨道的电子分布应尽先占据不同的轨道,且自旋平行。 C:在同一原子中,不可能有四个量子数完全相同的电子 D:在原子中,具有一组相同量子数的电子不能多于两个 2.已知298K时,反应2N2(g) + O2(g) 2N2O(g)的ΔrUΘm为166.5 kJ·mol-1,则该反应的ΔrHΘm为( )。
A:164 kJ·mol-1 B:82 kJ·mol-1 C:146 kJ·mol-1 D:328 kJ·mol-1 3.下列变化为绝热过程的是( )。
A:体系与环境无热量交换 B:体系不从环境吸收热量 C:体系温度不变 D:体系的内能保持不变 4.下列反应中,ΔrSΘm最大的是( )。
A:C(s) + O2(g) CO2(g) B:2SO2(g) + O2(g) 2SO3(g) C:CuSO4(s) + 5H2O(l) CuSO4·5H2O(s) D:N2(g) + 3H2(g) 2NH3(g) 5.零级反应速率常数的量纲是( )。
A:mol-1dm3s-1 B:moldm-3s-1 C:s-1 D:moldm-3 6.
以下的物质中ΔfHΘm不等于零的是( )。
A:Ne(g) B:Fe(s) C:Cl2(l) D:C(石墨) 7.
某一级反应的速率常数是9.510-2 min,那么这个反应的半衰期是( )。
A:0.55 min B:7.29 min C:0.27 min D:3.65 min 8.当反应A2 + B2 2AB 的速率方程为 r = k[A2]2 时,则此反应( )。
A:一定是非基元反应 B:不能肯定是否是基元反应 C:反应为一级反应 D:一定是基元反应 9.升高同等温度,反应速率增加幅度大的是( )。
A:双分子反应 B:活化能小的反应 C:多分子反应 D:活化能大的反应 10.
如果反应商等于1,那么以下关系中,正确的是( )。
A:
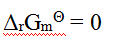 B:
B: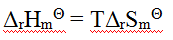 C:
C: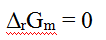 D:
D: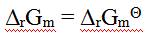 11.将固体NH4NO3溶于水,溶液变冷,其逆过程ΔG,ΔS的符号依次是( )。
11.将固体NH4NO3溶于水,溶液变冷,其逆过程ΔG,ΔS的符号依次是( )。A:+,- B:+,+ C:-,- D:-,+ 1.当溶液中H+离子浓度增大时,氧化能力不增强的氧化剂是
A:Cr2O72− B:NO3− C:PbCl62− D:MnO4− 2.已知:φƟ(Cu2+/Cu+) = 0.159 V、φƟ(I3−/I−) = 0.545 V,Cu2+能氧化I−的原因是
A:I3−的氧化能力强于Cu2+ B:生成沉淀升高了Cu2+/Cu+电位 C:过量I−离子降低了I3−/I−电位 D:I3−浓度较低使氧化反应进行 3.已知:φƟ(Fe3+/Fe2+) = 0.77V,φƟ(Sn4+/Sn2+) = 0.15V,则Fe3+与Sn2+反应的平衡常数对数值lgK为
A:(0.77−0.15)/0.059 B:(0.77−0.15)×3/0.059 C:(0.77+0.15)×2/0.059 D:(0.77−0.15)×2/0.059 4.已知:φƟ(O2/H2O) = 1.23 V,φƟ(Sn4+/Sn2+) = 0.15 V,SnCl2酸性水溶液能够稳定存在的原因是
A:O2与Sn2+反应的平衡常数太小 B:O2与Sn2+反应的速度太慢 C:水中溶解氧的浓度太低 D:溶液中氢离子浓度太低 5.用Na2C2O4标定KMnO4溶液浓度时,其滴定过程应
A:慢→快→慢 B:始终较快地进行 C:快→慢→慢 D:始终缓慢地进行
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!