第三章测试1.功,热,内能是状态函数。
A:错 B:对
答案:A
2.金刚石的标准摩尔生成吉布斯自由能等于零。
A:对 B:错 3.温度升高可增大可逆反应的正、逆反应速率常数。
A:错 B:对 4.在可逆反应中,吸热方向的活化能一般大于放热方向的活化能。
A:对 B:错 5.对于反应前后分子数相等的可逆反应而言,增大或减小总压力对平衡没有影响。
A:对 B:错 6.催化剂可改变化学反应的活化能,但不会改变反应平衡常数。
A:错 B:对 7.在298.15K时,ΔbHϴm(F-F)=158kJ·mol–1,ΔbHϴm(N≡N)=946kJ·mol–1,ΔbHϴm(F-N)=272kJ·mol–1,反应3F2(g)+N2(g) = 2NF3(g) 的ΔrHϴm等于
A:-212kJ·mol–1 B:212kJ·mol–1 C:-106kJ·mol–1 D:106kJ·mol–1 8.在298.15K时:ΔfGϴm,HI(g)= 1.7kJ·mol-1,则反应 H2(g) + I2(s) =2HI(g)的ΔrGϴm=-3.4kJ·mol-1。
A:错 B:对 9.对于基元反应:2A(g)+B(s)=C(g),在一定温度下,系统压力增加为原来的4倍,则反应速率是原来的
A:8倍 B:64倍 C:4倍 D:16倍 10.一定温度下,在某容器中注入A2(g)和B2(g),反应发生前,A2(g)和B2(g)的分压为p(A2)=100kPa,p(B2)=200kPa,当反应A2(g)+3B2(g)=2AB3(g)达平衡时,p(AB3) =100kPa,该温度下反应的Kϴ等于
A:625 B:0.0625 C:16 D:1.6×10-3 11.某反应的△rHϴm(298.15K)=112.6kJ·mol-1,△rSϴm(298.15K)=112.6J.mol-1·K-1,在标准态下该反应能自发进行的最低温度为
A:100K B:1000K C:1K D:10K 12.某反应500K时△rGϴm(500K)=-316.4kJ·mol-1,该温度下反应的Kϴ等于
A:1.1×1033 B:1.08 C:8.9×10-34 D:1.19 13.某温度下,反应 1/2A(g)+1/2B(g)=C(g)的Kc=10,则 2C(g)=A(g)+B(g)的 Kc为
A:100 B:0.05 C:20 D:0.01 14.已知反应A(s)+B(g)=C(g)+D(g)在一定温度下达平衡,若在恒温恒容下引入无关气体,则平衡
A:向左移动 B:向右移动 C:不移动 15.反应 A(g)+2B(g)=2C(g)在一定温度下达平衡,若其他条件不变,增加系统总压后,下列说法正确的是
A:平衡向右移动 B:反应平衡常数增大 C:反应平衡常数不变 D:反应速率常数不变 E:反应速率常数增大 16.
常温常压下, Zn可溶于盐酸, 其反应的ΔH, ΔS, ΔG应为
A:
ΔS > 0,ΔH > 0,ΔG< 0
B:ΔS< 0,ΔH < 0,ΔG< 0
C:ΔS > 0, ΔH < 0,ΔG <0
D:ΔS > 0,ΔH >0,ΔG >0
1.系统状态函数的变化与系统变化的具体途径无关,而与系统的始态和终态有关。( )A:对 B:错 2.标准摩尔反应焓变⊿rHmθ为生成物的标准摩尔生成焓(或者燃烧焓)之和减去反应物的标准摩尔生成焓(或者燃烧焓)之和。( )
A:对 B:错 3.一个化学反应不管是一步完成还是分几步完成,其热效应都相同。( )
A:对 B:错 4.标准状态下,任何温度下不可自发进行的反应,必定是⊿rHmθ>0,⊿rSmθ﹤0。( )
A:对 B:错 5.已知298K时下列热化学方程式:
① 2NH3(g) → N2(g) + 3H2(g) △rHmΘ = 92.2kJ·mol-1
② H2(g) + 1/2O2(g) → H2O(g) △rHmΘ = -241.8kJ·mol-1
③ 4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g) △rHmΘ = -905.6kJ·mol-1
试确定△fHmΘ(NH3,g,298k)=( ) kJ·mol-1
A:-90
B:-46.1 C:46.1 D:90.2 6.封闭体系的内能变化和环境的内能变化之间的关系为( )
A:▕△U体系▏﹤▕△U环境▏
B:▕△U体系▏=▕△U环境▏
C:▕△U体系▏﹥▕△U环境▏
D:△U体系 = △U环境
7.如果体系经一系列变化,最后又回到初始状态,则体系的 ( )
A:Q+W=0, △H=0, Qp=0
B:Q=0, W=0, △U=0
C:Q¹W, △H=Qp, △U=0
D:△H=0, △U=0, U ¹0
8.下面哪个反应表示
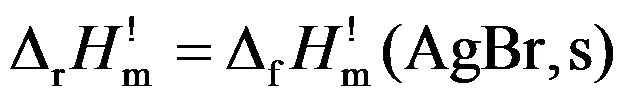 的反应? ( )
的反应? ( )A:Ag(s) + 1/2 Br2(l) = AgBr(s) B:2Ag(s) + Br2(g) = 2 AgBr(s)
C:Ag(s) + 1/2 Br2(g) = AgBr(s)
D:Ag+(aq) + Br-(aq) = AgBr(s) 9.已知反应A → 2B和2A → C的反应热分别为ΔH1和ΔH2,则反应C→4B的反应热ΔH3为 ( )
A:ΔH1+ΔH2 B:2ΔH1+ΔH2 C:ΔH2-2ΔH1 D:2ΔH1-ΔH
10.某化学反应的△rHmθ﹤0,△rSmθ﹤0,则对该反应自发进行有利的条件是( )
A:增加压力
B:使用催化剂 C:降低温度 D:升高温度 11.在100℃及标准压力下,1摩尔水变成水蒸汽的过程中,下列表示体系的△S、△H、Q、W等的关系,其中正确的是:( )
A:△S>0、△H>0、Q>0、W>0 B:△S>0、△H>0、Q>0、W<0
C:△S<0、△H>0、Q>0、W<0
12.试由下列数据, BCl3(l) BCl3(g)
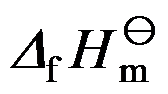 / kJ·mol-1 -427.2 -403.76
/ kJ·mol-1 -427.2 -403.76 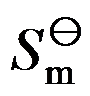 / J·mol-1·K-1 206.27 289.99, 确定压力为101 kPa时BCl3的沸点为 ( )
/ J·mol-1·K-1 206.27 289.99, 确定压力为101 kPa时BCl3的沸点为 ( )A:280℃
B:7℃
C:-280℃
D:-17℃
1. 某化学反应其△H = -122 kJ/mol,∆S = 231 J/(mol·K),则此反应在下列哪种情况下可自发进行 ( )。
A:在任何温度下都不能自发进行 B:仅在低温下自发进行 C:仅在高温下自发进行 D:在任何温度下都能自发进行 2. 下列情况中属于封闭系统的是( )。
A:用水壶烧开水 B:氯气在绝热容器中燃烧 C:反应在密闭容器中进行 D:氢氧化钠与盐酸在烧杯里进行 3. 下列方法能改变可逆反应的平衡常数的是( )。
A:改变反应物的浓度 B:改变反应温度 C:改变反应的总压力 D:采用催化剂 4.下列过程中熵值增大的是( )。
A:碳酸钙受热分解 B:汞的挥发 C:氯化氢与氨气反应 D:食盐溶解于水 5.室温下,元素最稳定单质的标准生成焓为( )。
A:>0 B:<0 C:0 D:1 6.对于一个化学反应,下列说法中正确的是( )。
A:活化能越小,反应速率越快 B:△S越负,反应速率越快 C:△H越负,反应速率越快 D:活化能越大,反应速率越快 7.△G大于零的反应是不可能发生的。( )
A:对 B:错 8.可逆反应达到平衡时,其正、逆反应的速率都为零。( )
A:错 B:对 9.△S为负值的反应均不能自发进行。( )
A:错 B:对 10.反应速率常数取决于反应温度,与反应物浓度无关。( )
A:错 B:对 1.下列各组量子数,不正确的是 ( )。
A:n=3, l=2, m=-2, m=-1/2 B:n=2, l=1, m=0, m=-1/2 C:n=3, l=0, m=1, m=1/2 D:n=2, l=1, m=-1, m=1/2 2.角量子数l=2的某一电子,其磁量子数m ( )。
A:可以是五个数值中的任一个 B:可以有无限多少数值 C:只有一个数值 D:可以是三个数值中的任一个 3.下列各组量子数中,不可能存在的是 ( )。
A:3,1,2,1/2; B:2,1,1,1/2; C:3,0,0,1/2; D:1,0,0,-1/2 4.
我们说的决定原子的等价轨道数目的量子数是( )。
A:
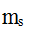 B:l
C:m
D:n
5.
B:l
C:m
D:n
5.用来决定多电子原子的原子轨道能量的量子数是哪一个? ( )。
A:m,
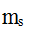 B:l, m
C:n, l
D:n, m
6.下列说法中符合泡利原理的是 ( )。
B:l, m
C:n, l
D:n, m
6.下列说法中符合泡利原理的是 ( )。A:在同一电子亚层上各轨道的电子分布应尽先占据不同的轨道,且自旋平行。 B:原子处于稳定的基态时,其电子尽先占据最低的能级 C:在同一原子中,不可能有四个量子数完全相同的电子 D:在原子中,具有一组相同量子数的电子不能多于两个 7.
PCl杂化方式是( )。
A:
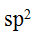 B:sp
C:
B:sp
C: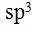 D:
D: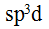 8.
8.CO₂分子中σ键的数目( )。
A:3 B:0 C:1 D:2 9.
HCO分子中π键的数目是多少?( )。
A:3 B:0 C:1 D:2 10.下列物质哪些是金属晶体( )。
A:BO(s) B:CaCl(s) C:Au (s) D:BCl(s) 1.随机误差影响测定结果的精密度。( )
A:对 B:错 2.一般说来,精密度高,准确度一定高。( )
A:错 B:对 3.pH=3.05的有效数字有2位。( )
A:对 B:错 4.用分析天平准确称取,完全溶解后定量转移至容量瓶,并准确定容,可直接配制NaOH标准溶液。
A:错 B:对 5.用滴定度表示标准溶液的浓度时,若以%/mL为单位,即每毫升标准溶液所对应的待测物的百分含量,要求待测样品的质量必须是固定的。
A:错 B:对 6.已知某清洁剂有效成分的质量分数标准值为54.46%,测定4次所得的平均值为54.26%,标准偏差为0.05%。那么置信度为0.95时,平均值与标准值之间存在显著性差异。
A:对 B:错 7.滴定终点与化学计量点不一致,会产生( )。
A:偶然误差 B:试剂误差 C:仪器误差 D:系统误差 8.称取邻苯二甲酸氢钾来标定NaOH溶液的浓度。若锥形瓶内有水,对标定结果的影响是( )。
A:正误差 B:负误差 C:不能确定 D:无影响 9.配制重铬酸钾标准溶液时容量瓶内溶液没有摇匀。用该溶液测定铁,对测定结果的影响是( )。
A:正误差 B:负误差 C:降低精密度 D:对准确度无影响 10.下列叙述中错误的是( )。
A:系统误差呈正态分布 B:系统误差具有单向性 C:系统误差又称可测误差 D:方法误差属于系统误差
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!