第四章测试1.在氨水中加入少量固体NH4Ac后,溶液的pH值将( )。
A:不变 B:减小 C:增大 D:无法判断
答案:B
2.实验室中检验H2S气体,通常用的是( )。
A:石蕊试纸 B:醋酸铅试纸 C:pH试纸 D:KI淀粉试纸 3.
在室温下,时醋酸的电离度约为2.0%,其Ka =1.75×10-5,则该醋酸的浓度(molL-1)是多少?( )。
A:0.44 B:0.005 C:4.0 D:0.044 4.
在以下的离子中,碱性最强的为( )。
A:Ac- B:CN- C:NH4+ D:NO2- 5.
H2AsO4- 的共轭碱为( )。
A:H3AsO4 B:AsO43- C:H2AsO3- D:HAsO42- 6.将HAc-Ac- 缓冲溶液稀释一倍,溶液中的[H3O+]就减少到原来的一半。( )
A:错 B:对 7.区分强酸,需要使用强碱。( )
A:对 B:错 8.某盐的水溶液pH = 7,表明该盐不发生水解。( )
A:对 B:错 9.产生同离子效应时,一般不会产生盐效应。( )
A:错 B:对 10.Na+和NaOH属于共轭酸碱对。( )
A:对 B:错 1.定量分析的任务是( )
A:测定物质的组成及含量 B:测定物质的含量 C:测定物质中的组成 D:测定物质的有关组分的含量 2.下列论述中错误的是( )
A:系统误差呈正态分布 B:方法误差属于系统误差 C:系统误差又称为可测误差 D:系统误差可消除 3.下列各项定义中不正确的是( )
A:平均偏差是单次测量偏差的平均值 B:偏差是指测定结果与平均结果之差 C:相对误差是绝对误差在真实结果中所占百分率 D:绝对误差是测定值与真实值之差 4.准确度大小用( )表示,( )越小,准确度越高。 ( )
A:偏差、偏差 B:误差、误差 C:误差、偏差 D:偏差、误差 5.在消除系统误差的前提下,平行测定次数越多,平均值越接近( )值。
A:真实值 B:计算值 C:平均偏差 D:标准偏差 6.下列论述中,正确的是 ( )。
A:准确度高,一定需要精密度高 B:进行分析时,过失误差是不可避免的 C:精密度高,系统误差一定小 D:精密度高,准确度一定高 7.下述情况所引起的误差中,不属于系统误差的是( )。
A:移液管转移溶液之后残留量稍有不同 B:滴定管刻度未经校正 C:天平的两臂不等长 D:称量时使用的砝码锈蚀 8.在下列各数中,有效数字位数为四位的是( )。
A:
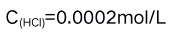 B:pH=10.80
C:
B:pH=10.80
C: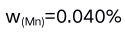 D:
D: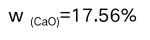 9.滴定分析的相对误差一般要求达到0.1%,使用常量滴定管时,消耗标准滴定溶液的体积控制在( )。
9.滴定分析的相对误差一般要求达到0.1%,使用常量滴定管时,消耗标准滴定溶液的体积控制在( )。A:10mL以下 B:10~15mL C:20~30mL D:40~50mL 10.某铁矿石样品经三次平行测定,测得Fe平均含量为40.50%,若真实含量为40.00%则:40.50% - 40.00%=0.50%为( )
A:绝对偏差 B:相对误差 C:绝对误差 D:相对偏差 11.对某试样进行多次平行测定,得出MgO的平均含量为43.3%,则其中某个测定值(如43.5%)与此平均值之差为该次测定的( )
A:绝对偏差 B:相对偏差 C:相对误差 D:绝对误差 12.某水样经分析测得
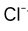 含量(mg/L)为:115,123,122,115,125。求分析结果的RSD值为( )
含量(mg/L)为:115,123,122,115,125。求分析结果的RSD值为( )A:0.039 B:0 C:0.035 D:0.078 1.可逆反应PCl5(g) ===PCl3(g)+Cl2(g)在某温度下体积为1L,总压力为100kPa,若加入N2使总压力增加为200kPa,体积不变,则PCl5的分解率减小。( )
A:错 B:对 2.某一可逆反应,当Q>KΘ时,反应自发地向逆方向进行。 ( )
A:对 B:错 3.某温度下,反应SO2(g)+
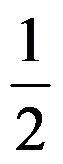 O2(g)
O2(g) SO3(g)的平衡常数KӨ=50,在同一温度下,反应2SO3(g)=2SO2(g)+O2(g)的KӨ值应是: ( )
SO3(g)的平衡常数KӨ=50,在同一温度下,反应2SO3(g)=2SO2(g)+O2(g)的KӨ值应是: ( ) A:100
B:4×10-4
C:2500
D:2×10-2
4.当改变下列条件时,会对化学反应平衡常数产生影响的是( )
A:增加反应时间
B:升高反应温度
C:增加反应物浓度
D:增加生成物浓度
5.反应CaO(s)+CO2(g) →CaCO3(s)在1073K时的KΘ=100/17,此时的分压为( )。
A:(17/100)pΘ
B:(100/17)2p
C:(100/17)pΘ
D:(100/17)1/2pΘ
6.如果某反应的KΘ≥1,则它的 ( )
A:△r G m≥0 B:△r GΘm≤0
C:△r G Θm≥0 D:△r G m≤0
1.将0.1mol/L的HAc溶液稀释,其解离度增大,H+浓度也增大。 ( )
A:对 B:错 2.一般来说,酸碱指示剂的变色范围越宽,变色越敏锐。 ( )
A:错 B:对 3.
下列阴离子的水溶液,若浓度(单位mol·L-1)相同,则何者碱性最强?( )
A:CN- (KӨHCN = 6.2×10-12) B:F- (KӨHF = 3.5×10-4) C:Cl- (KӨHCl>>1) D:S2- (K ӨHS- = 7.1×10-15 , KӨH2S= 1.3×10-7) E:CH3COO- (KӨHAc = 1.8×10-5) 4.下列物质只能是质子碱的是( )
A:HS- B:H2O C:NH4+ D:CO32- 5.等浓度的一元弱酸强碱盐溶液 AX,AY,AZ的pH值分别是8,9,10,这三种弱酸的KaӨ值由大到小的顺序是 ( )
A:HX>HZ>HY B:HX>HY>HZ C:HZ>HY>HX D:HZ>HX>HY 6.欲配制pH=9的缓冲溶液,应选用下列何种弱酸或弱碱和它们的(强酸或强碱的)盐来配制( )
A:HCOOH (KaӨ=1.8×10-4) B:HNO2 (KaӨ=4.6×10-4) C:NH3·H2O (KbӨ=1.8×10-5) D:HAc (KaӨ=1.8×10-5) E:NH2OH (KbӨ=9.1×10-9) 7.用纯水把下列溶液稀释10倍时,其中pH值变化最大的是( )
A:1 mol/L HAc+1 mol/L NaAc B:0.1mol/L HCl C:1 mol/L NH3·H2O D:1 mol/L HAc E:1 mol/L NH3·H2O + 1 mol/LNH4Cl 8.滴定分析中,一般利用指示剂颜色的突变来判断等当点的到达,在指示剂变色时停止滴定。这一点称为( )
A:化学计量点 B:滴定 C:滴定终点 D:滴定分析 9.向氨气的水溶液中加入适量的氯化铵,会使:( )
A:溶液pH值增大 B:KӨNH3·H2O减小 C:溶液pH值减小 D:KӨNH3·H2O增大 10.下列物质中,可用直接法配制标准溶液的是 ( )
A:HCl B:NaOH C:重铬酸钾 D:HAc 11.甲基橙作指示剂,用NaOH滴定HCl时,其终点颜色变化为 ( )
A:无色变红 B:黄变红 C:红变黄 D:红变无色 12.用基准物硼砂标定盐酸溶液时,滴定速度过快,导致滴定剂盐酸溶液过量,则标定出的盐酸溶液浓度 ( )
A:不好判断 B:偏高 C:没有影响 D:偏低 1.已知H3AsO4的pKa1 = 2.2, pKa2 = 6.9, pKa3 = 11.5,在pH等于7.0时,溶液中[H2AsO4-]和[HAsO42-]之比等于
A:10-0.1 B:109.3 C:102.2 D:104.7 2.用同浓度的NaOH溶液滴定0.1mol/L的醋酸(pKa=4.74)溶液,化学计量点时溶液的pH值为
A:8.72 B:5.28 C:9.26 D:4.74 3.浓度为0.1 mol·L−1的下列酸或碱,能用NaOH或HCl直接滴定的是
A:HF (pKa=3.18) B: NH4Cl (NH3的pKb=4.74) C:NaAc (HAc的pKa=4.74) D:HCN (pKa=9.21) 4.
下列物质中适合加入NaOH配制成pH = 5的缓冲溶液的是
A:HAc B:硼酸 C:NaAc D:三个都可以 5. 含NaOH和Na2CO3混合碱液,用HCl滴至酚酞变色,耗去V1 mL,继以甲基橙为指示剂,又耗去HCl V2 mL,则V1和V2的关系准确的是:
A:V1 = 2V2 B:V1 > V2 C:V1 < V2 D:V1 = V2 6.用盐酸标准溶液测定碳酸钠的含量时,盐酸和碳酸钠的物质的量之比为
A:1:1 B:视所用指示剂变色点的pH而定 C:1:2 D:2:1 7.OH−的共轭酸是:
A:H+ B: H2O C: O2− D: H3O+ 8. HCl和H3BO3的混合溶液用NaOH溶液滴定,在滴定曲线上会出现几个突跃?
A:1 B:2 C:4 D:3 9.NaH2PO4水溶液的质子条件式为:
A:[H+]=2[HPO42-] + [H2PO4-]+3[PO43-] + [OH-] B:[H+] +[H3PO4] = 2[PO43-]+ [HPO42-] + [OH-] C:[H+] + [H3PO4] =[HPO42-] + [PO43-] + [OH-] D:H+ +H3PO4 = 2PO43-+ HPO42- + OH- 10.酸碱指示剂的理论变色点的特征为
A:[In-]/[HIn]=10 B:[In-]/[HIn]=0.11 C:pH=pKb D:pH=pKa
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!