第六章测试1.用Na2C2O4标定KMnO4溶液浓度时,温度不能过高是为了
A:防止HCl挥发而减弱KMnO4的氧化能力 B:用Na2C2O4标定KMnO4溶液浓度时,温度不能过高是为了 C:防止生成MnO2 D:防止H2C2O4分解
答案:D
2.在滴定反应Cr2O72− + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O中,达到化学计量点时,下列说法正确的是
A:电对Fe3+/Fe2+和Cr2O72−/Cr3+的电位相等 B:溶液中c(Fe3+)与c(Cr3+)相等 C:电对Fe3+/Fe2+和Cr2O72−/Cr3+的电位不等 D:溶液中不存在Cr2O72−和Fe2+ 3.已知:φƟ'(Fe3+/Fe2+) = 0.68V,φƟ'(Sn4+/Sn2+) = 0.14V,用Fe3+滴定Sn2+,在化学计量点的电位是
A:0.41V B:0.32V C:0.75V D:0.68V 4.用0.02 mol·L−1 KMnO4分别滴定(1) 0.1 mol·L−1 Fe2+和(2) 0.01 mol·L−1 Fe2+,两种情况下其滴定突跃是
A:(2) > (1) B:无法判断 C:一样大 D:(1) > (2) 5.使用Fe3+标准溶液滴定Sn2+时,可以使用KSCN作指示剂,是因为
A:Sn4+与KSCN生成有色物质 B:Fe3+与KSCN生成有色物质 C:Fe2+使有色物质KSCN褪色 D:Fe3+将KSCN氧化成有色物质 1.紫外-可见吸收光谱的产生是由于( )
A:基态原子中电子由基态跃迁到激发态产生的 B:物质分子内电子由激发态回到基态产生的 C:物质分子内电子由基态跃迁到激发态产生的 D:原子中电子由激发态回到基态产生的 2.
分子吸收紫外可见光后,可发生哪类分子能级跃迁( )
A:振动能级跃迁 B:转动能级跃迁 C:电子能级跃迁 D:其它三项都能发生 3.分子荧光与化学发光均为第一激发态的最低振动能级跃至基态中各振动能级产生的光辐射,它们的主要区别在于( )
A:跃至基态中的振动能级不同 B:无辐射弛豫的途径不同 C:产生光辐射的能源不同 D:分子的电子层不同 4.荧光物质分子在光照射下激发到较高能级,在很短时间内首先因碰撞而下降到第一电子激发态各振动能级,然后下降至基态能级,从而发射出荧光。( )
A:错 B:对 5.
红外光谱法的基本原理可概述为( )
A:物质的红外光谱是物质分子吸收红外辐射,分子的振动,转动能级改变产生 B:吸收峰的强度决定于基态、激发态的能级差 C:其它三项都对 D:红外光谱的吸收峰数,由分子的红外活性振动决定 6.有甲、乙两个不同浓度的同一物质有色溶液,用同一波长的光测定。当甲溶液用 1cm 比色皿,乙溶液用 2cm 比色皿时获得的吸光度值相同,则它们的浓度关系为 ( )
A:乙是甲的二分之一 B:乙是甲的两倍 C:甲是乙的四倍 D:甲是乙的二分之一 7.以下说法错误的是 ( )
A:摩尔吸光系数e随浓度增大而增大 B:透射比T随比色皿加厚而减小 C:透射比T随浓度增大而减小 D:吸光度A随浓度增大而增大 8.
符合比尔定律的有色溶液,浓度为c时,透射比为T0,浓度增大一倍时,透射比的对数为 ( )
A:
A:位移 B:消失 C:分裂 D:精细结构更明显 10.荧光光谱的形状不仅与物质的性质有关,而且还与激发波长有关( )
A:错 B:对 1.配合物中心离子的配位数等于 ( )
A:配位原子所具有的孤对电子总数 B:配位原子数 C:配位体数 D:配位体中的原子数 2.下列物质能溶于氨水的是: ( )
A:AgI B:
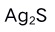 C:AgCl
D:
C:AgCl
D: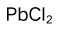 3.下列说法错误的是 ( )
3.下列说法错误的是 ( )A:
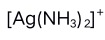 的一级稳定常数
的一级稳定常数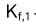 与二级离解常数
与二级离解常数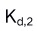 的乘积等于1。
B:配位数就是配位原子的个数。
C:四氨合铜(Ⅱ)离子比二乙二胺合铜(Ⅱ)离子稳定。
D:配合物的形成体大多数是中性原子或带正电荷的离子。
4.
的乘积等于1。
B:配位数就是配位原子的个数。
C:四氨合铜(Ⅱ)离子比二乙二胺合铜(Ⅱ)离子稳定。
D:配合物的形成体大多数是中性原子或带正电荷的离子。
4.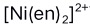 离子中镍的配位数和氧化数分别是( )
离子中镍的配位数和氧化数分别是( )A:2, +2 B:6, +2 C:4, +2 D:2, +3 5.利用酸效应曲线可选择单独滴定金属离子时的: ( )
A:最低酸度 B:最低 pH 值 C:pH 突跃范围 D:最高 pH 值 6. 当 M 与 Y 反应时, 溶液中有另一配位剂 L 存在,若
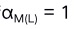 , 则:( )
, 则:( )A:M与L没有副反应 B:M与L的副反应较弱 C:M与L的副反应严重 D:[M]=[L] 7.下列配离子中属于外轨型的是( )。
A:
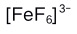 B:
B: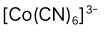 C:
C: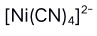 D:
D: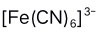 8.以
8.以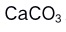 为基准物质标定EDTA溶液的实验中, 需要EDTA溶液荡洗2~3次的仪器是( )
为基准物质标定EDTA溶液的实验中, 需要EDTA溶液荡洗2~3次的仪器是( )A:锥形瓶 B:容量瓶 C:移液管 D:滴定管 9.用EDTA测定水中的
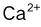 的含量时,
的含量时,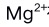 有干扰,实验中采用何种方法消除其干扰( )
有干扰,实验中采用何种方法消除其干扰( )A:加三乙醇胺 B:调节pH值≈12 C:加KCN D:分离 10.配位化合物的d-d跃迁吸收光波长位于哪个区域? ( )
A:紫外-可见 B:X-射线 C:微波 D:红外 11.配位滴定中,定量滴定的必要条件是 ( )
A:
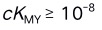 B:
B: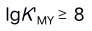 C:
C: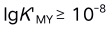 D:
D: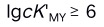 12.晶体场理论认为,配位化合物中心离子与配位体是依靠静电作用相结合。( )
12.晶体场理论认为,配位化合物中心离子与配位体是依靠静电作用相结合。( )A:错 B:对 13.
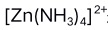 是无色配合物,说明
是无色配合物,说明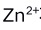 不发生d-d跃迁。( )
不发生d-d跃迁。( )A:对 B:错 14.EDTA滴定金属离子反应中,因酸效应的作用,使
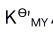 总是大于
总是大于 。 ( )
。 ( )A:错 B:对 15.金属指示剂配合物MIn应与游离指示剂In的颜色应明显不同。( )
A:对 B:错 16.用EDTA标准溶液滴定无色金属离子时,终点的颜色是配合物MY的颜色。( )
A:错 B:对 17.因
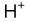 与配体Y结合,使配体Y参加主反应的能力下降的作用称为酸效应。 ( )
与配体Y结合,使配体Y参加主反应的能力下降的作用称为酸效应。 ( )A:错 B:对 18.在配位滴定中,如果条件稳定常数
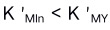 时,则会出现指示剂的封闭现象。( )
时,则会出现指示剂的封闭现象。( )A:错 B:对 1.每一个原子中的原子轨道需要有3个量子数才能具体确定,而每一个电子则需要4个量子数才能具体确定。 ( )
A:对 B:错 2.同周期从左向右主族元素原子半径减小的幅度比副族元素要大。( )
A:错 B:对 3.在分子中,成键轨道填充的电子越多,体系的能量越低,分子就越稳定。( )
A:错 B:对 4.电子对之间斥力大小顺序:成键电对与成键电对>孤电对与孤电对>孤电对与成键电对。( )
A:对 B:错 5.下列各组量子数中,合理的一组是( )
A:n = 3,l = 3,m = +1,si = -1/2
B:n = 4,l = 25,m = -1,si = +1/2
C:n = 3,l = 1,m = +1,si = +1/2
D:n = 4,l = 2,m = +3,si = -1/2
6.下列各电子亚层不可能存在的是( )
A:5 p
B:6 d
C:8s
D:2 f
7.下列有关元素核外电子排布错误的是: ( )
A:Cu (Z=29) :1s2 2s2 2p6 3s2 3p6 3d9 4s2
B:Cr (Z=24) :1s2 2s2 2p6 3s2 3p6 3d5 4s1
C:Ca(Z = 20):1s2 2s2 2p6 3s2 3p6 4s2
D:Fe(Z = 26):1s2 2s2 2p6 3s2 3p6 3d6 4s2
8.某元素的+2氧化态离子的核外电子结构为1s22s22p63s23p63d5,此元素在周期表中的位置是:( )
A:d区 第四周期 Ⅷ族
B:d区 第四周期 ⅦB族
C:p区 第三周期 ⅤA族
D:d区 第四周期 ⅤB族
9.下列说法中正确的是( )
A:π键比σ键更牢固
B:共价键既有饱和性又有方向性
C:离子键没有极性
D:共价键仅存在于共价型化合物中
10.下列分子中相邻共价键的夹角最小的是( )
A:H2O
B:NH3
C:BF3
D:CCl4
11.下列分子中,键和分子均具有极性的是 ( )
A:Cl2
B:CO2
C:BF3
D:NH3
12.下列说法正确的是( )
A:分子内氢键和分子间氢键都属于分子间作用力
B:氢键的强度介于化学键和范德华力之间,其大小和 H 原子两侧原子的电负性有关
C:只要分子中有氢原子,分子间就可以形成氢键
D:氢键属于共价键,因此既有饱和性又有方向性
1.离子-电子法应用广泛,适用于所有氧化还原反应方程式的配平。
A:错 B:对 2.书写原电池符号时,习惯上把负极写在左边,正极写在右边。
A:错 B:对 3.书写原电池符号时,若电极反应中的物质本身不能作为导电电极,可以用Pb电极作为导电电极。
A:错 B:对 4.同一电对在不同介质中的电极反应和φϴ值不同。
A:对 B:错 5.
Cu2++ 2e-⇌ Cu 和 2Cu2++4e- ⇌2Cu的φϴ(Cu2+/Cu) 相同。
A:错 B:对 6.KMnO4标准溶液液可以采用直接法配制。
A:错 B:对 7.
还原电势φϴOx/Red值越大,电对中氧化型物质的氧化能力越强。
A:对 B:错 8.若增大I- 浓度,则电对CuI/Cu的的电极电势也增大。
A:对 B:错 9.把反应 2Ag++Cu = Cu2++ 2Ag设计成对应原电池,若在负极中加入Na2S,则原电池电动势
A:增大 B:不变 C:减小 10.
用A4+ 滴定B2+ 时,已知φϴ'(B4+/B2+)=0.16V,φϴ'(A4+/A3+)=1.66V,滴定至化学计量点时的电极电势φsp等于
A:
0.66V
B:0.91V
C:1.16V
11.已知φϴAg+/Ag=0.7999V,φϴAgI/Ag=-0.149V,(忽略离子强度I影响),则KϴspAgI=9.3×10-17
A:对 B:错 12.
已知φϴClO3-/Cl-=1.45V,φϴCl2/ Cl- =1.36V,则φϴClO3-/Cl2= 1.47V
A:错 B:对 13.
已知φϴI2/I-= 0.535V,φϴ Fe3+/Fe2+ = 0.771V,计算表明:反应I2(s)+2Fe2+(0.10mol∙L-1)=2Fe3+(0.010 mol∙L-1)+2I-(0.010mol∙L-1)
A:
逆向进行
B:处于平衡状态
C:正向进行
14.已知:φϴClO3-/Cl- = 1.45 V,φϴClO4-/ClO3-= 1.19 V,298.15K 时反应 4ClO3- = 3 ClO4- + Cl-的 Kϴ 等于
A:
2.5×104
B:1.5×1013
C:2.2×1026
15.已知φϴO2/H2O = 1.229 V,则φϴO2/OH- 等于
A:
0.216V
B:0.338
C:0.400V
16.配平氧化还原反应HClO4 + P4 → HCl +H3PO4 时,需要在反应式的左边添加A:8H2O B:10H2O C:14H2O D:12H2O 17.把反应MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O设计成对应原电池,做原电池正极的电对是
A:MnO4-/ Mn2+ B:MnO4-/ Fe2+ C:Fe3+/ Fe2+
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!