第五章测试1.在EDTA配位滴定中,铬黑T作为金属指示剂的合适酸度为
A:pH<3.9 B:pH=12 C:pH=8.0~10 D:pH=3.9~6.3
答案:C
2.在非缓冲溶液中用EDTA滴定金属离子时,溶液的pH值将
A:与金属离子价态有关 B:升高 C: 降低 D: 不变 3.一般lgKMY'=8所对应的酸度是金属离子M能够被准确滴定的
A:最高酸度 B:与滴定方向有关 C:最低酸度 D:最佳酸度 4.在与金属离子形成配合物时,1分子EDTA最多可提供几对电子
A:4 B:6 C:7 D:5 5.
用EDTA直接滴定无色金属离子,终点所呈现的颜色是()。
A:
游离指示剂的颜色
B:选项A和B的混合色
C:指示剂与金属离子所形成的颜色
D:EDTA与金属离子所形成的配合物颜色
6.下列有关EDTA的酸效应的叙述正确的是A:酸效应系数越大,络合滴定曲线的突跃范围越大 B:酸效应系数越小,络合物MY的稳定性越强 C:pH值越大,酸效应系数越大 D:酸效应系数越大,络合物MY的稳定性越强 7.对配位反应的条件稳定常数K’MY而言,下列说法正确的是
A:K’MY的大小完全是由KMY决定的 B:K’MY的大小只受溶液酸度的影响 C:K’MY的大小表示有副反应发生时主反应进行的程度 D:
K’MY是常数,不受任何条件限制;
8.EDTA在水溶液中有几种存在型体
A:4 B:7 C:6 D:5 9.关于络合滴定的突跃范围,说法不对的是
A:条件稳定常数越大,突跃范围越大 B:产物的副反应系数越大,突跃范围越大 C:反应物浓度越大,突跃范围越大 D:反应物的副反应系数越大,突跃范围越大 10.在配位滴定中,指示剂被封闭是指
A:指示剂与金属离子形成胶体或沉淀而使终点拖长 B:指示剂与金属离子形成更稳定的配合物而不能被EDTA置换 C:指示剂已变质不能使用 D:
指示剂与金属离子不起反应 1.测定氯化钠含量时,平行测定三次,结果为0.3950、0.3954、0.3948,则平均值为( )。
A:0.3951 B:0.3948 C:0.0003 D:0.0002 2.测定氯化钠样品,平行测定四次结果:0.3022, 0.3034, 0.3038, 0.3042,则可疑值0.3022( )。(P =0.95)
A:无法确定 B:根据需要进行取舍 C:可以舍去 D:不能舍去 3.可用于减少测量过程中的偶然误差的方法( )。
A:进行空白试验 B:增加平行试验的次数 C:进行对照实验 D:进行仪器校准 4.下列有关偶然误差的叙述中,不正确的是( )。
A:偶然误差正负误差出现的机会相等 B:偶然误差在分析中是不可避免的 C:偶然误差具有单向性 D:偶然误差由一些不确定的偶然因素造成 5.衡量样本平均值的离散程度时,应采用( )。
A:相对标准偏差 B:极差 C:标准偏差 D:平均值的标准偏差 6.用25 mL移液管移出的溶液体积应记录为( )。
A:25.0 mL B:25 mL C:25.00 mL D:25.000 mL 7.对某试样进行三次平行测定,得CaO平均含量为30.6%,而真实含量为30.3%,则30.6% - 30.3% = 0.3%为( )。
A:相对误差 B:绝对偏差 C:相对偏差 D:绝对误差 8.下列操作不正确的是( )。
A:容量瓶不能用来久储溶液。 B:滴定管读数应读到小数点后两位。 C:滴定管和移液管使用时需用操作溶液润洗。 D:万分之一分析天平应读到小数点后五位。 9.滴定分析中常用指示剂颜色的突变来判断化学计量点的到达,这点称为( )。
A:突跃点 B:理论终点 C:滴定终点 D:化学计量点 10.以酸度计测定某溶液的pH=1.25,该数字的有效数字位数是( )。
A:3位 B:4位 C:1位 D:2位 1.盐效应使HAc的解离程度( ),同离子效应使HAc的解离程度( )。( )
A:增大 减小 B:增大 增大 C:减小 增大 D:增大 增大 2.根据酸碱质子理论,下列物质全部是酸的是( )。
A:
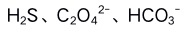 B:
B: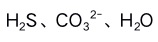 C:
C: D:
D: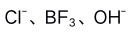 3.0.10 mol/L HAc溶液的pH值为(已知HCN的
3.0.10 mol/L HAc溶液的pH值为(已知HCN的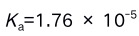 )( )。
)( )。A:1.00 B:2.89 C:1.19 D:3.59 4.某混合碱先用HCl滴定至酚酞变色,耗去
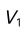 ,继续以甲基橙为指示剂,耗去
,继续以甲基橙为指示剂,耗去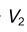 ,已知
,已知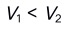 ,其组成是( )。
,其组成是( )。A:
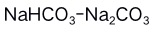 B:
B: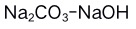 C:
C: D:
D: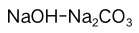 5.在0.1 mol/L的NaF溶液中( )。
5.在0.1 mol/L的NaF溶液中( )。A:
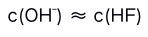 B:
B: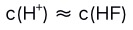 C:
C: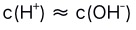 D:
D: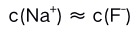 6.下列那一选项对会HAc的离解度造成影响( )。
6.下列那一选项对会HAc的离解度造成影响( )。A:同离子效应 B:浓度 C:盐效应 D:温度 7. 不影响缓冲溶液的缓冲容量大小的因素是( )。
A:缓冲溶液的组分浓度比 B:外加的酸量 C:外加的碱量 D:缓冲溶液的PH值范围 8.纯水的pH值一定为7。( )
A:对 B:错 9.强碱可以用来滴定弱酸,但弱碱不能用来滴定弱酸。( )
A:对 B:错 10.酸碱反应实际上是质子转移的反应。( )
A:对 B:错 11.根据酸碱质子理论,强酸反应之后变为弱酸。( )
A:对 B:错 12.配置NaOH溶液时,必须使用煮沸后冷却的蒸馏水。( )
A:错 B:对 13.对酚酞不显颜色的溶剂一定是酸性的。( )
A:错 B:对 14.双指示剂就是混合指示剂。( )
A:对 B:错 15.根据酸碱质子理论,强酸稀释之后变为弱酸。( )
A:对 B:错 1.溶液中,反应物A在t1时的浓度为c1,t2时的浓度为c2,则可以由(c1-c2)/(t1 -t2)计算反应速率,当△t→0时,则为平均速率。( )
A:错 B:对 2.若某反应的速率方程式中反应物浓度的方次与反应方程式中的计量系数一致,则该反应必定为基元反应。( )
A:错 B:对 3.在mA + nB→pC的反应中m、 n、p为各物质的化学计量数,现测得C每分钟增加a mol/L,B每分钟减小1.5a mol/L,A每分钟减小0.5a mol/L,则m:n:p为( )
A:2:2:3
B:1:3:2
C:3:1:2
D:2:3:2
4.某反应的速率方程式是v=k cx(A) cy(B),当c(A)减少50%时,v降低为原来的1/4,当c(B)增大2倍时,v增大1.41倍,则x、y分别为:( )
A:x=0.5,y=1
B:x=2,y=0.7
C:x=2,y=2
D:x=2,y=0.5
5.对给定的化学反应,下列说法正确的是 ( )
A:△G越负,反应速度越快。
B:△H越负,反应速度越快。
C:活化能Ea越小,反应速度越快。
D:△S越负,反应速度越快。
6.某可逆反应的△rHmΘ<0,当温度升高时,下列叙述中正确的是:( )。
A:正反应速率系数增大的倍数比逆反应速率系数增大的倍数小
B:逆反应速率系数增大,正反应速率系数减小,KΘ减小。
C:正反应速率系数增大,逆反应速率系数减小,KΘ增大。
D:正反应速率系数减小,逆反应速率系数增大,KΘ增大。
1.Kϴsp只与温度有关
A:对 B:错 2.一定温度下,在难溶电解质的饱和溶液中,Qi = Kϴsp
A:错 B:对 3.pH越小,难溶弱酸盐的溶解度越小
A:错 B:对 4.在用BaSO4重量法测定SO42-时,如果BaSO4中有少量PbSO4 ,则测定结果偏高
A:对 B:错 5.在用BaSO4重量法测定Ba2+时,如果BaSO4中有少量PbSO4 ,则测定结果偏高
A:错 B:对 6.中性溶液中可以用莫尔法测定Br-
A:对 B:错 7.测定I-时可用莫尔法直接滴定
A:对 B:错 8.对于AB2型难溶强电解质,Kϴsp 与溶解度s(mol·L-1)的关系是:Kϴsp 等于
A:27s4 B:s2 C:4s3 9.在0.010mol·L-1 M2+金属离子溶液中,不断通入H2S气体至饱和,M2+开始沉淀时所需H+浓度为0.32mol∙L-1(已知pKϴsp MS=23.04.,H2S的pKϴa1 =6.89,pKϴa2 =14.15)
A:错 B:对 10.称量形是Mg2P2O7, 被测组份是P2O5, 换算因数F的表达式为Mg2P2O7/P2O5
A:错 B:对 11.反应 M2++ H2S = MS + 2H+的 Kϴ等于(已知 pKϴsp MS=19.04, H2S的pKϴa1=6.89,pKϴa2=14.15)
A:0.5 B:2 C:100 D:0.01 12.用莫尔法测定Cl-,如果指示剂浓度过浓,则测定结果偏低
A:错 B:对 13.已知CaF2的溶度积 Kϴsp=2.7×10-11,HF的Kϴa=3.5×10-4,则CaF2在保持[H+]=0.35mol•L-1溶液中的溶解度为
A:1.9×10-2 mol∙L-1 B:2.6×10-3 mol∙L-1 C:3.2×10-3 mol∙L-1 14.已知难溶强电解质 AB, A2B, A3B 的溶度积常数分别为1.6 ×10-11,3.2 ×10-17,2.7 × 10-15 ,溶解度S (mol•L -1)最大的是
A: AB B: A2B C: A3B 15.向金属离子M2+和N2+的混合液中滴加浓NaOH溶液,计算表明: M2+和N2+开始生成氢氧化物沉淀时,所需pH值分别为4.0和6.0, M2+和N2+沉淀完全时,所需pH值分别为5.0和8.0,下列选项正确的是
A:M2+和N2+分离完全所需要控制的pH值范围是6.0~8.0 B:M2+和N2+分离完全所需要控制的pH值范围是4.0~5.0 C:M2+和N2+分离完全所需要控制的pH值范围是5.0~6.0 D:M2+先沉淀 E:N2+先沉淀 16.下列试剂中使 BaSO4(s)溶解度不变的是
A:Na2SO4 B: BaCl2 C:NaCl D: H2O
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!