第九章测试1.色谱分析中,用于定性分析的参数是( )。
A:保留值 B:分离度 C:峰面积 D:峰宽
答案:A
2.在GC法中,直接表征组分在固定相中停留时间长短的参数是( )。
A:死时间 B:调整保留时间 C:保留指数 D:相对保留值 3.色谱分析的定量依据是组分的含量与( )成正比。
A:峰面积 B:保留值 C:半峰宽 D:峰宽 4.使用氢火焰离子化检测器,选用下列哪种气体作为载气最合适?( )
A:He B:Ar C:N2 D:H2 5.
假如在试样中组分的沸点范围很宽,分离的不理想,那么可以采取的措施是( )。
A:程序升温 B:采用最佳载气线速 C:选择合适的固定相 D:降低柱温 6.
下列仪器中,用于高效液相色谱的检测器,不能使用梯度洗脱的为( )。
A:荧光检测器 B:二极管阵列检测器 C:紫外检测器 D:示差折光检测器 7.
我们在选择固定液时的一般原则是( )。
A:化学稳定性 B:熔点高低 C:沸点高低 D:相似相溶 8.液相色谱中通用型检测器是( )。
A:荧光检测器 B:紫外检测器 C:示差折光检测器 D:热导池检测器 9.在液相色谱中,按分离原理分类,液固色谱法属于( )。
A:离子交换色谱法 B:排阻色谱法 C:物理色谱法 D:吸附色谱 10.液相色谱流动相过滤必须使用何种颗粒的过滤膜( )。
A:0.45 µm B:0.4 µm C:0.5 µm D:0.6 µm 1.下列说法正确的是( )。
A:轨道角度分布图表示电子运动轨迹 B:电子云角度分布图表示电子运动轨迹 C:电子云角度分布图表示波函数随θ,φ变化的情况 D:轨道角度分布图表示波函数随θ,φ变化的情况 2.用来表示核外某一电子运动状态的下列量子数中合理的一组是( )。
A:3,1,2,
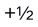 B:2,1,-1,
B:2,1,-1,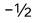 C:1,2,0,
C:1,2,0,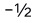 D:0,0,0,
D:0,0,0,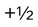 3.下列元素的原子中外层电子构型为
3.下列元素的原子中外层电子构型为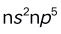 的是( )。
的是( )。A:Na B:Si C:Mg D:F 4.下列关于共价键说法错误的是( )
A:两个原子间键长越短,键越牢固 B:两个原子半径之和约等于所形成的共价键键长 C:键的强度与键长无关 D:两个原子间键长越长,键越牢固 5.下列分子中既有σ键又有π键的是( )
A:Cu B:
 C:
C: D:
D: 6.主量子数n=3时,有3s,3p,3d,3f等四种原子轨道。( )
6.主量子数n=3时,有3s,3p,3d,3f等四种原子轨道。( )A:对 B:错 7.电负性越大的元素的原子越容易获得电子。( )
A:对 B:错 8.分子间普遍存在、且起主要作用的分子间力是色散力。( )
A:对 B:错 9.
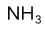 和
和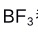 都是4原子分子,所以二者空间构型相同。( )
都是4原子分子,所以二者空间构型相同。( )A:对 B:错 10.
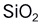 是原子晶体 。( )
是原子晶体 。( )A:对 B:错 1.在用离子-电子法配平酸性介质半反应方程式时,方程式左边多了n个O ,应在方程式左边加上n个H+。( )
A:错 B:对 2.电对的氧化型和还原型都生成沉淀,如氧化型的溶解度比还原型小,则电极电势变小。( )
A:错 B:对 3.氧化还原反应平衡常数的大小与其反应所组成原电池正、负极的电极电势差值有关,差值越大,平衡常数越小。( )
A:对 B:错 4.在有H+参与的氧化还原反应中,如果两个电极的标准电极电势相差不大,适当改变酸度,可能改变反应的方向。( )
A:错 B:对 5.在反应H3AsO4 + Zn + HNO3 → AsH3 + Zn (NO3 )2 + H2O 中,下列说法错误的是( )
A:被还原的物质是H3AsO4
B:被氧化的物质是Zn
C:还原剂是Zn ,得到电子
D:氧化剂是H3AsO4
6.用离子电子法配平碱性介质中的反应式:Cl2 + NaOH → NaCl + NaClO3,则( )
A:在少O的一边加同倍OH-以平衡质量守恒
B:配平的氧化半反应为:Cl2 + 12OH- - 10e- →2ClO3- + 6H2O
C:在多O的一边加2倍OH-以平衡质量守恒
D:配平的还原半反应为:Cl + e-→Cl-
7.将银和硝酸银溶液组成的半电池与锌和硝酸锌溶液组成的半电池通过盐桥构成原电池,该电池符号是( )
A:(-) Ag | AgNO3 (aq) || Zn (NO3 )2 (aq) | Zn (+)
B:(-) Ag,AgNO3 (aq) || Zn (NO3 )2 (aq) | Zn (+)
C:(-) Ag | AgNO3 (aq)|| Zn (NO3 )2 (aq) | Zn (+)
D:(-) Zn | Zn (NO3 )2 (aq)|| AgNO3 (aq) | Ag (+)
8.已知EΘ(Cr2O72-/Cr3+)>EΘ(Fe3+/Fe2+)>EΘ(Cu2+/Cu)>EΘ(Fe2+/Fe),则上述诸电对的各物种中最强的氧化剂和最强的还原剂分别为( )。
A:Cr2O72-,Fe
B:Cu2+,Fe2+
C:Cr2O72-,Fe2+
D:Fe3+,Cu
9.已知:Eө(Zn2+/Zn) =-0.763 V, Eө (Cu2+/Cu) =0.337 V ,则此 Zn|Zn2+(0.5mol•L-1)
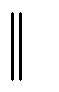 Cu2+(0.1mol•L-1)|Cu原电池的电动势为( )
Cu2+(0.1mol•L-1)|Cu原电池的电动势为( )A:1.08 V
B:1.071 V
C:1.100 V
D:1.109 V
10.已知Eө(Ag+/Ag)=0.799V,Kspө(AgBr)=5.010-13。Eө([Ag(S2O3)2]3-/Ag)=0.017V,则[Ag(S2O3)2]3-的稳定常数Kfө为( )
A:1.62 * 1013
B:1.62 * 1012
C:7.62 * 1014
D:7.62 * 1012
11.根据电势图
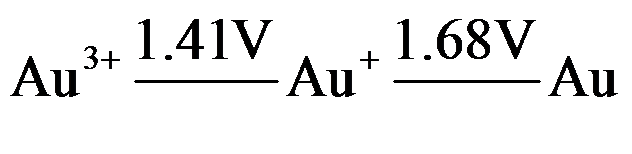 判断能自发进行反应的是 ( )
判断能自发进行反应的是 ( )A:2Au → Au+ + Au3+
B:Au3+ + 2Au → 3Au+
C:Au + Au+ → 2Au3+
D:3Au+ → Au3+ + 2Au
12.已知钒元素的电势图及下列各电对的Eθ值:
V(V)1.00VV(Ⅳ)0.31V V(Ⅲ)-0.255V V(Ⅱ)
Eθ(Zn2+ / Zn)=-0.763V Eθ(Sn4+ / Sn2+)=0.154V;
Eθ(Fe3+ / Fe2+)=0.771V Eθ(Fe2+ / Fe)=-0.44V;
欲将V(V)只还原到V(Ⅳ),下列还原剂中合适的是( )
A:Sn2+
B:Zn
C:Fe2+
D:Fe
1.
下列化合物中既存在离子键和共价键,又存在配位键的是
A:
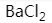


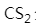 分子空间构型为直线形,是因为C原子采取了sp杂化。
分子空间构型为直线形,是因为C原子采取了sp杂化。
A:错 B:对 3.
为了解释多原子分子的几何构型,鲍林提出了杂化轨道理论,进一步补充和发展了价键理论。
A:错 B:对 4.
MgO属于离子晶体,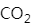 属于分子晶体,
属于分子晶体,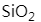 属于原子晶体。
属于原子晶体。
A:错 B:对 5.
氨与水分子间存在的作用力包括氢键与范德华力。
A:对 B:错 6.
在化合物分子中,含有极性共价键的分子一定是极性分子,非极性分子中都是非极性共价键。
A:错 B:对 7.
根据杂化轨道理论,杂化轨道的数目不一定等于参与杂化的原子轨道数目。
A:错 B:对
温馨提示支付 ¥3.00 元后可查看付费内容,请先翻页预览!